Munkacsoportunk döntően molekuláris patológiai módszerekkel vizsgálja különböző daganatos és gyulladásos kórképek pathomechanizmusát, illetve diagnosztikus és prognosztikus jellemzőit. Vizsgálataink elsősorban a gyomor-, az urogenitális szervek-, emlő-, illetve tüdő betegségeire fókuszálnak. A csoport kiemelt kutatási területe a felső tápcsatornai gyulladásos és daganatos megbetegedések, ezek közül is elsősorban a Helicobacter pylori fertőzés és a gyomor daganatai patogenezisének valamint diagnosztikus, prognosztikus és prediktív tényezőinek tanulmányozása.
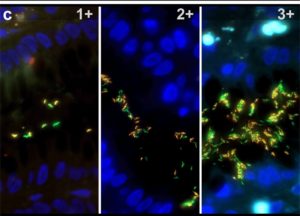
A Helicobacter pylori (H. pylori) fertőzés, kezelés nélkül, élethosszig tart. Hosszútávon a baktérium a gyomornyálkahártya sorvadásával járó gyulladását, peptikus fekélyek kialakulását, gyomorrák és -limfóma kialakulását okozhatja. A fertőzés kezelésében leggyakrabban alkalmazott elsővonalbeli hármas terápia clarithromycint tartalmaz és hatékonysága elsősorban az e gyógyszer ellen kialakuló rezisztencia miatt nem kielégítő. Intézetünkben a H. pylori pozitívnak bizonyuló gyomorbiopsziás minták a kórokozó clarithromycin-érzékenységének meghatározására fluoreszcens in situ hibridizációs (FISH) vizsgálaton esnek át. Ennek során a fajspecifikus próba a H. pylori baktériumok riboszómáinak kis alegységében található rRNS egy szakaszához kötődik. A clarithromycin rezisztenciáért a riboszómák nagy alegységében a 23S rRNS peptidil transzferáz centrumának pontmutációi felelősek, melyekhez – jelenlétük esetén – az erre specifikus próbák kötődnek. A teszt eredményeként a clarithromycin érzékeny H. pylori baktériumok zölden, a rezisztensek pedig zölden és vörösen is fluoreszkálnak a fluoreszcens mikroszkópos vizsgálat során. Ezért a színcsatornák egyesítésével készült képeken a rezisztens baktériumok sárgán tűnnek fel.
A módszer kitűnő érzékenységét munkacsoportunk is igazolta [Kocsmár É. és mtsai, 2017]. A technika egyik nagy előnye, hogy a rezisztens és érzékeny baktériumok együttes megjelenítésével kevert rezisztencia státuszú fertőzés diagnózisa is felállítható. Röst Gergellyel, az SZTE Bolyai Intézet matematikusával a clarithromycin rezisztencia populációs terjedésének matematikai modellezését végeztük, mely a primer rezisztens esetek (clarithromycin rezisztencia előzetes makrolid fogyasztás nélkül) eredetére is fényt derített, és a rangos Nature Communications lapban közöltük [Kocsmár É. és mtsai, 2021]. Jelenlegi tanulmányaink a kevert rezisztens fertőzés kialakulásának hátterére, valamint kezelési lehetőségeire fókuszálnak.
Emellett munkacsoportunk a gyomor daganatos megbetegedéseinek prognosztikus és prediktív faktorait vizsgálja formalinnal fixált, paraffinba ágyazott szövetmintákon. A leggyakrabban előforduló gyomorrák mellett vizsgálataink kiterjednek a gyakran adenocarcinomával asszociáltan megjelenő gastrointestinalis stromalis tumorokra (GIST) is.
A munkacsoport foglalkozik továbbá uroonkológiai kutatásokkal [Kocsmár I. és mtsai, 2020], azon belül is kiemelten a nem-izominvazív hólyagrákoknak a sokkal rosszabb prognózisú, a húgyhólyag izomfalát beszűrő, ún. izominvazív formába átmenetét előrejelző molekuláris markerek vizsgálatával. Emellett a munkacsoport vizsgálja a tüdőrákok egyes, FISH módszerrel detektálható molekuláris eltéréseinek diagnosztikus problémáit is, továbbá a CUP (Cancer of Unknown Primary origin) szindróma klinikopatológiai jellemzőit.
A munkacsoport tagjai:
Dr. Lotz Gábor PhD, egyetemi docens, vezető kutató
Dr. Kocsmár Éva, PhD-ösztöndíjas
Dr. Kocsmár Ildikó, PhD-ösztöndíjas
Dr. Szirtes Ildikó, klinikai szakorvos
Dr. Szalai Luca, rezidens (Országos Onkológiai Intézet)
Kurucz Anita, molekuláris biológus
Jakab Ákos, TDK-hallgató
Kim Ju Ea, TDK-hallgató
Kiemelt közlemények:
Kocsmár É, Buzás GM, Szirtes I, Kocsmár I, Kramer Z, Szijártó A, Fadgyas-Freyler P, Szénás K, Rugge M, Fassan M, Kiss A, Schaff Z, Röst G, Lotz G.
Primary and secondary clarithromycin resistance in Helicobacter pylori and mathematical modeling of the role of macrolides.
Nat Commun. 2021 Apr 15;12(1):2255. doi: 10.1038/s41467-021-22557-7. PMID: 33859206; PMCID: PMC8050269.
Kocsmár É, Kocsmár I, Szalai L, Lendvai G, Szijártó A, Schaff Z, Kiss A, Kovalszky I, Papp G, Lotz G.
Cross-testing of major molecular markers indicates distinct pathways of tumorigenesis in gastric adenocarcinomas and synchronous gastrointestinal stromal tumors.
Sci Rep. 2020 Dec 17;10(1):22212. doi: 10.1038/s41598-020-78232-2. PMID: 33335133; PMCID: PMC7747598.
Smuk G, Pajor G, Szuhai K, Morreau H, Kocsmár I, Kocsmár É, Pajor L, Kajtár B, Sárosi V, Lotz G, Tornóczky T.
Attenuated isolated 3′ signal: A highly challenging therapy relevant ALK FISH pattern in NSCLC.
Lung Cancer. 2020 May;143:80-85. doi: 10.1016/j.lungcan.2020.03.007. Epub 2020 Mar 10. PMID: 32272316.
Kocsmár É, Kocsmár I, Buzás GM, Szirtes I, Wacha J, Takáts A, Hritz I, Schaff Z, Rugge M, Fassan M, Kiss A, Lotz G.
Helicobacter pylori heteroresistance to clarithromycin in adults-New data by in situ detection and improved concept.
Helicobacter. 2020 Feb;25(1):e12670. doi: 10.1111/hel.12670. Epub 2019 Nov 8. PMID: 31701608.
Kocsmár I, Pajor G, Gyöngyösi B, Székely E, Varga M, Kocsmár É, Kenessey I, Beöthe T, Süle N, Majoros A, Szendrői A, Nyírády P, Kiss A, Riesz P, Lotz G.
Development and Initial Testing of a Modified UroVysion-Based Fluorescence In Situ Hybridization Score for Prediction of Progression in Bladder Cancer.
Am J Clin Pathol. 2020 Jan 2;153(2):274-284. doi: 10.1093/ajcp/aqz165. PMID: 31732739.
Kocsmár É, Szirtes I, Kramer Z, Szijártó A, Bene L, Buzás GM, Kenessey I, Bronsert P, Csanadi A, Lutz L, Werner M, Wellner UF, Kiss A, Schaff Z, Lotz G.
Sensitivity of Helicobacter pylori detection by Giemsa staining is poor in comparison with immunohistochemistry and fluorescent in situ hybridization and strongly depends on inflammatory activity.
Helicobacter. 2017 Aug;22(4). doi: 10.1111/hel.12387. Epub 2017 Apr 12. PMID: 28402048.