A nem-szteroid gyulladásgátlók (NSAID-ok), melyek ciklooxigenáz (COX) gátló hatásuk révén fájdalom-, láz- és gyulladáscsökkentő hatásúak, világszerte a leggyakrabban alkalmazott gyógyszerek közé tartoznak. Jól ismert, hogy gyomor- és nyombélfekélyt okozhatnak, mely savszekréció gátlókkal mérsékelhető. Az NSAID-ok azonban a gasztrointesztinális rendszer disztális részeit is károsítják, az új, modern diagnosztikai eljárások (pl. videó kapszula endoszkópia) elterjedésével pedig kiderült, hogy a vékonybélkárosodás (enteropátia) jóval gyakoribb és súlyosabb, mint azt korábban gondolták (Bjarnason et al., 2018).
Az elmúlt két évtizedben történt erőfeszítések ellenére az NSAID enteropátia komplex pathomechanizmusa egyelőre csak részben feltárt (1. ábra).
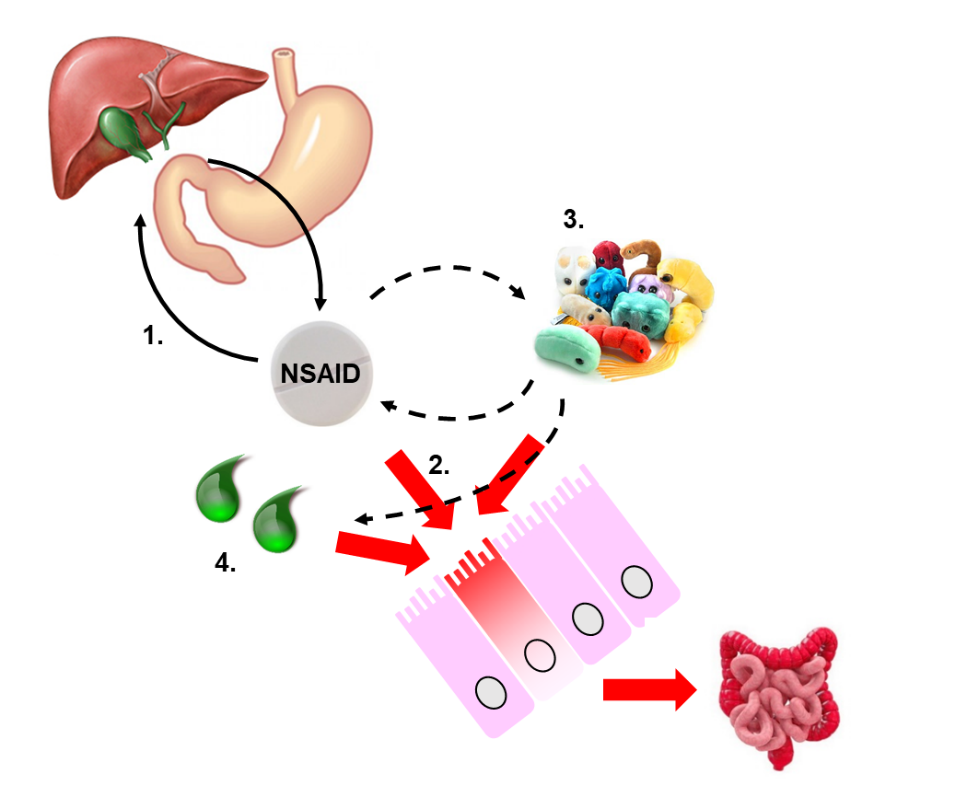
Kutatásunk célja az NSAID-ok által okozott bélkárosodásban szerepet játszó új mechanizmusok és terápiás célpontok azonosítása, mely segítségével a jövőben új kezelési lehetőségek kifejlesztésére nyílhat lehetőség. A kísérletekhez széles körben alkalmazott állatkísérletes modellt alkalmazunk; patkányokat és egereket kezelünk különböző NSAID-okkal, majd a kialakult gasztrointesztinális károsodást makroszkóposan, hisztológiai módszerrel, illetve kölönböző molekuláris biológiai módszerekkel vizsgáljuk (pl. Western blot, ELISA, qPCR, enzimaktivitás mérések) (2. ábra).

Mivel a bélbaktériumok és epesavak kiemelten fontos szerepet játszanak a bélkárosodás kialakulásában, kutatásunk során az NSAID-okkal kezelt állatok bélflórájának összetételét (3. ábra), valamint a primer és szekunder epesavak mennyiségét is vizsgáljuk.

Elsajátítható képességek: kísérleti állatok kezelése, az enteropátia súlyosságának makroszkópos kiértékelése, hisztológia, Western blot, ELISA
Témacsoport vezető: Dr. Zádori Zoltán, egyetemi docens
A témában korábban megjelent cikkeink:
- Zádori ZS, Király K, Al-Khrasani M, Gyires K. Interactions between NSAIDs, opioids and the gut microbiota – Future perspectives in the management of inflammation and pain. Pharmacol Ther. 2023 241:108327.
- Hutka B, Lázár B, Tóth AS, Ágg B, László SB, Makra N, Ligeti B, Scheich B, Király K, Al-Khrasani M, Szabó D, Ferdinandy P, Gyires K, Zádori ZS. The Nonsteroidal Anti-Inflammatory Drug Ketorolac Alters the Small Intestinal Microbiota and Bile Acids Without Inducing Intestinal Damage or Delaying Peristalsis in the Rat.Front Pharmacol. 2021 12:664177.
- Lázár B, László SB, Hutka B, Tóth AS, Mohammadzadeh A, Berekméri E, Ágg B, Balogh M, Sajtos V, Király K, Al-Khrasani M, Földes A, Varga G, Makra N, Ostorházi E, Szabó D, Ligeti B, Kemény Á, Helyes Z, Ferdinandy P, Gyires K, Zádori ZS. A comprehensive time course and correlation analysis of indomethacin-induced inflammation, bile acid alterations and dysbiosis in the rat small intestine.Biochem Pharmacol. 2021 190:114590.
- Lázár B, Brenner GB, Makkos A, Balogh M, László SB, Al-Khrasani M, Hutka B, Bató E, Ostorházi E, Juhász J, Kemény Á, László T, Tiszlavicz L, Bihari Z, Giricz Z, Szabó D, Helyes Z, Ferdinandy P, Gyires K, Zádori ZS. Lack of Small Intestinal Dysbiosis Following Long-Term Selective Inhibition of Cyclooxygenase-2 by Rofecoxib in the Rat. Cells. 2019 8(3):251.