Projektek
A kissejtes tüdőrák Immunoterápia rezisztenciájának és válaszkészségének vizsgálata
Projektvezető: Görbe Anikó

Projektfelelős: Paál Ágnes

A kissejtes tüdőrák (SCLC) a legrosszabb prognózisú rosszindulatú daganatok egyike, amelynek terápiájában az elmúlt három évtizedben nem történt jelentős előrelépés. Az első ígéretes eredményeket az immunellenőrzési pont gátlók (ICI-k) alkalmazása hozta, de a siker messze elmarad a nem kissejtes tüdőráknál tapasztaltaktól, ahol az ICI-k alkalmazása áttörést jelentett a terápiában. Az SCLC-ben a kiterjedt stádiumú betegségben szenvedő betegeknél esetenként a túlélés 1-2 hónappal hosszabb lehet.
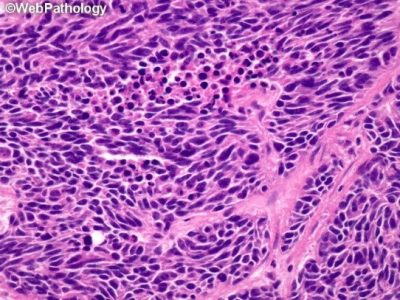
A kissejtes tüdőrák szövettani képe
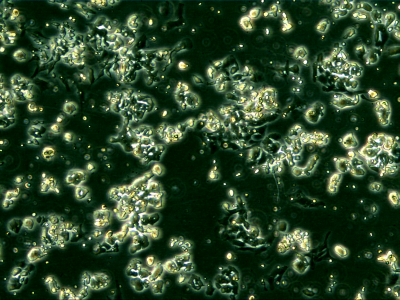
Kissejtes tüdőrák sejtek kultúrában
Ezek arra utalnak, hogy új megközelítésekre van szükség az SCLC immunterápiára adott válaszának és rezisztenciájának megértéséhez. Számos kutatócsoport azonosította az SCLC molekuláris altípusait, amelyek részben megfelelnek egymásnak. Például a gyengébb neuroendokrin marker-expresszió gyakran erősebb immuninfiltrációval jár együtt (neuroendokrin-alacsony, immunoázis tumorok), ami az ilyen tumorok jobb immunterápiás érzékenységet feltételezheti.
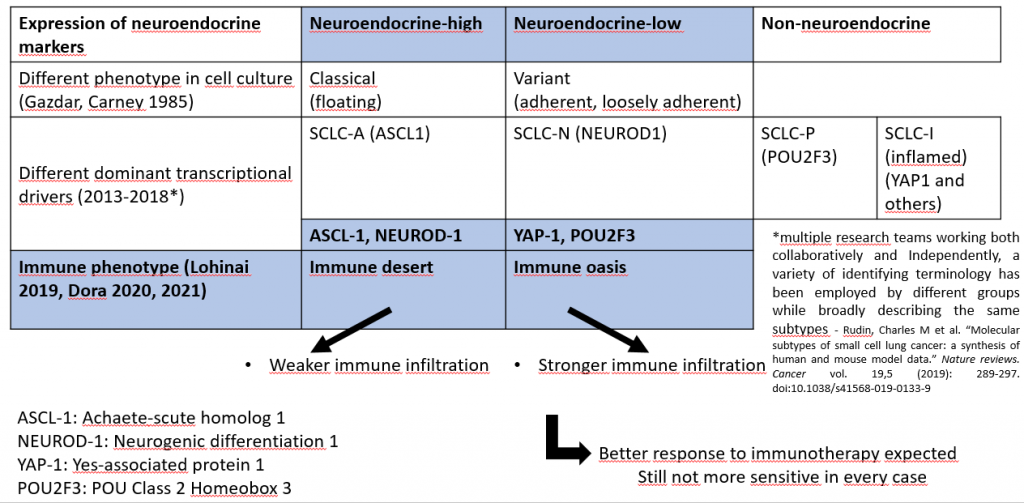
Egy lehetséges út a hatékonyabb terápia felé: az SCLC fejlődő alosztályozása
Az erősebb immun infiltráció ellenére a tumorok nem mindig reagálnak az ICI-kre, és immunszuppresszív molekulák helyi fokozott expresszióját is kimutatták.
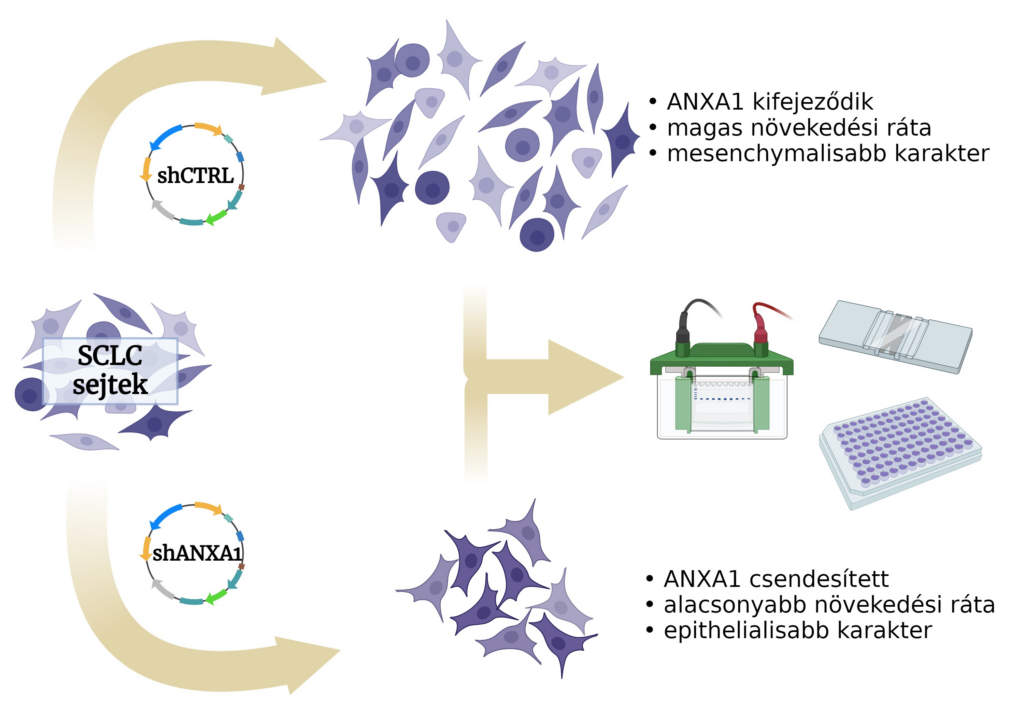
Vizsgáljuk az egyik ilyen immunszuppresszív molekula, az annexin A1 expressziójának csendesítését neuroendokrin-alacsony SCLC-sejtvonalak kultúráiban. Feltételezésünk szerint a malignus fenotípus egyes jellemzőit befolyásolhatja az annexin A1 csendesítése, mint például a növekedési sebességet, az epithelio-mesenchymális átmenetet, a metabolikus eltolódást, a domináns transzkripciós drivereket és a klasszikus kemoterápiás szerekkel, ciszplatinnal és etopoziddal szembeni érzékenységet.
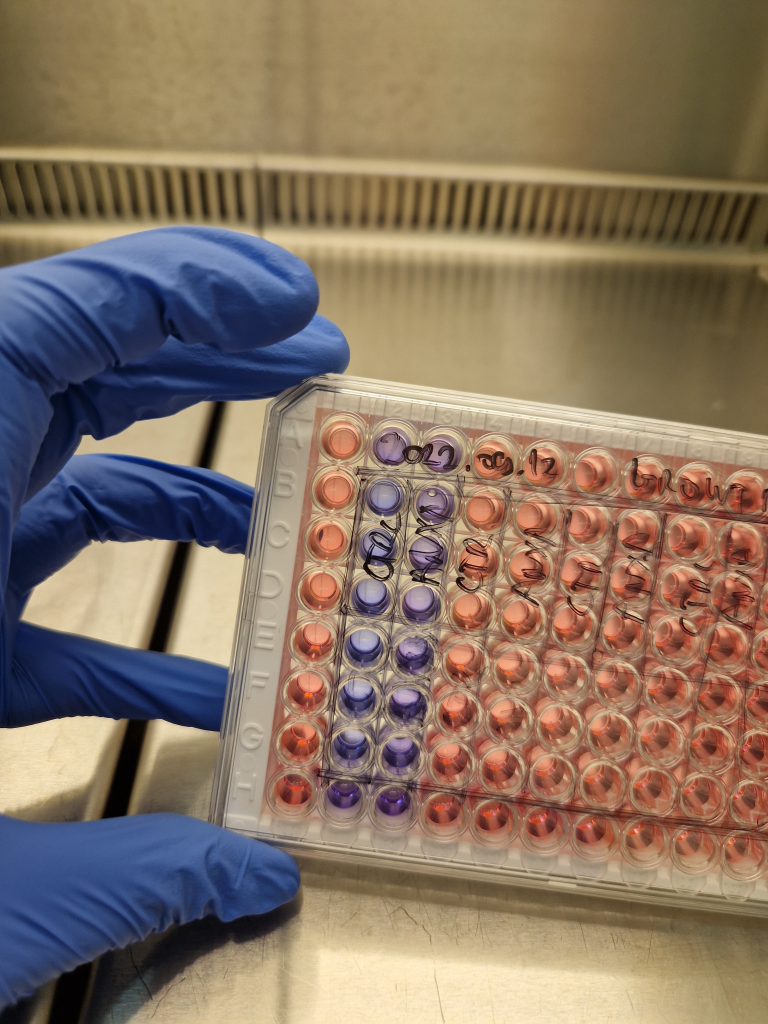
Fluoreszcens viabilitás esszé
Úgy gondoljuk, hogy az annexin A1 csendesítés hatásainak vizsgálata segíthet megérteni a kissejtes tüdőrák új, a terápia szempontjából fontos aspektusait.
Tanulási lehetőségek:
- kissejtes tüdőrák sejtvonalak tenyésztése, fenntartása
- növekedési ráta vizsgálata sejtszámolással és fluoreszcens viabilitás esszékkel
- sejtek kezelése, kemoszenzitivitás mérése fluoreszcens vibabilitás esszékkel
- western blot
(BioRender.com)
Kapcsolódó közlemények:
- Dora, David et al. “Neuroendocrine subtypes of small cell lung cancer differ in terms of immune microenvironment and checkpoint molecule distribution.” Molecular oncology 14,9 (2020): 1947-1965. doi:10.1002/1878-0261.12741
- Dora, David et al. “Characterization of Tumor-Associated Macrophages and the Immune Microenvironment in Limited-Stage Neuroendocrine-High and -Low Small Cell Lung Cancer.” Biology 10,6 502. 4 Jun. 2021, doi:10.3390/biology10060502
- Dora, David et al. “Protein Expression of immune checkpoints STING and MHCII in small cell lung cancer.” Cancer immunology, Immunotherapy : CII 72,3 (2023): 561-578. doi:10.1007/s00262-022-03270-w
A miRNS-ek fejlesztése, mint új terápiás eszköz a szív- és érrendszeri betegségek kezelésében

Projektvezetők: Prof. Dr. Ferdinandy Péter, Dr. Görbe Anikó
 |
 |
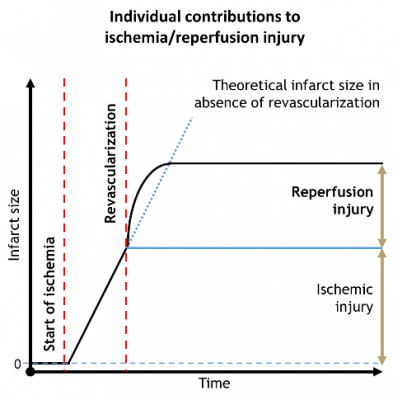 Az iszkémiás szívbetegségek és kóros következményeik világszerte a vezető halálokok közé tartoznak. A myocardialis ischaemia akut kezelésében az egyik legfontosabb feladat a szöveti perfúzió helyreállítása.
Az iszkémiás szívbetegségek és kóros következményeik világszerte a vezető halálokok közé tartoznak. A myocardialis ischaemia akut kezelésében az egyik legfontosabb feladat a szöveti perfúzió helyreállítása.
Sajnos a reperfúzió a szívizom további károsodását is okozza, amit általában reperfúziós sérülésnek neveznek. Bizonyos esetekben ez felelős a teljes szívizomkárosodás feléért.
Annak ellenére, hogy preklinikai körülmények között számos kis molekulájú gyógyszerről megállapították, hogy csökkenti az infarktus méretét, egyiket sem sikerült humán terápiába alkalmazni. Ezért új megközelítéseket és hatékony kardioprotektív molekulajelölteket kell találni a jövőbeli gyógyszerfejlesztéshez.
Paolo Severino, Andrea D’Amato et al., 2020, Int J Mol Sci., 10.3390/ijms21218118
Az elmúlt évtizedekben az oligonukleotid molekulák, például a miRNS-ek potenciális alkalmazása vonzó és innovatív megközelítésként jelent meg a különböző kórképek, köztük a rákos megbetegedések, sőt a szív- és érrendszeri betegségek kezelésében.
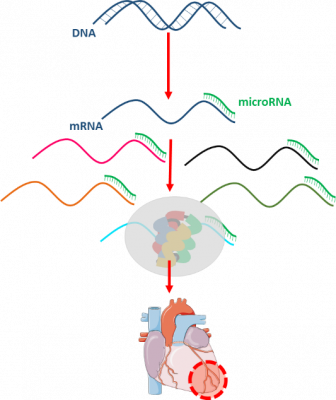 Megállapították, hogy a miRNS-ek diszregulációja fontos szerepet játszik a szívinfarktus patomechanizmusában. A mikroRNS-ek rövid, ~18-25 nukleotid hosszúságú nem kódoló RNS-szekvenciák, amelyek a transzkripció után a génexpressziót negatívan szabályozzák poszt-transzkripciós szinten vagy a transzláció gátlásával, vagy a cél mRNS degradációjának elősegítésével. Egyetlen mikroRNS akár egy egész útvonalat is szabályozhat, ezért a miRNS-ek nagy potenciállal rendelkeznek abban, hogy multi-target gyógyszerekké váljanak a multifaktoriális eredetű betegségek kezelésében. A mikroRNS-terápiák két különböző típusa a mikroRNS-mimics és az antagomiRs (Varga ZV et al., Am J Physiol Heart Circ Physiol, 10.1152/ajpheart.00812.2013). A mikroRNS mimics kétszálú szekvenciák, beleértve a „vezető” szálat, amelynek szekvenciája megegyezik az endogén megfelelőjével, és egy nem teljesen komplementer kísérőszálat, amely a leválasztás után lebomlik. Az antagomiR-ek lényegében egyszálú oligonukleotidok, amelyek komplementerek az endogén miRNS-hez, ezáltal blokkolva annak működését.
Megállapították, hogy a miRNS-ek diszregulációja fontos szerepet játszik a szívinfarktus patomechanizmusában. A mikroRNS-ek rövid, ~18-25 nukleotid hosszúságú nem kódoló RNS-szekvenciák, amelyek a transzkripció után a génexpressziót negatívan szabályozzák poszt-transzkripciós szinten vagy a transzláció gátlásával, vagy a cél mRNS degradációjának elősegítésével. Egyetlen mikroRNS akár egy egész útvonalat is szabályozhat, ezért a miRNS-ek nagy potenciállal rendelkeznek abban, hogy multi-target gyógyszerekké váljanak a multifaktoriális eredetű betegségek kezelésében. A mikroRNS-terápiák két különböző típusa a mikroRNS-mimics és az antagomiRs (Varga ZV et al., Am J Physiol Heart Circ Physiol, 10.1152/ajpheart.00812.2013). A mikroRNS mimics kétszálú szekvenciák, beleértve a „vezető” szálat, amelynek szekvenciája megegyezik az endogén megfelelőjével, és egy nem teljesen komplementer kísérőszálat, amely a leválasztás után lebomlik. Az antagomiR-ek lényegében egyszálú oligonukleotidok, amelyek komplementerek az endogén miRNS-hez, ezáltal blokkolva annak működését.
1. A miRNS-ek feltárása farmakokinetikai profilalkotása egérmodellekben
Projekt felelősök: Dr. Makkos András, Szabó Márta
 |
 |
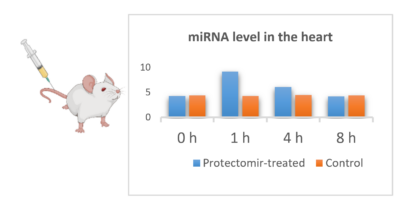 Bár a miRNS-ek alkalmazását aktívan vizsgálják különböző indikációkban, kevéssé ismertek farmakokinetikai tulajdonságaik és a különböző miRNS-ek jellemzőinek különbségei. Ezért célunk a miRNS-mimic-ek és az antagomiR-ek farmakokinetikai profiljának feltárása egészséges állatokban.
Bár a miRNS-ek alkalmazását aktívan vizsgálják különböző indikációkban, kevéssé ismertek farmakokinetikai tulajdonságaik és a különböző miRNS-ek jellemzőinek különbségei. Ezért célunk a miRNS-mimic-ek és az antagomiR-ek farmakokinetikai profiljának feltárása egészséges állatokban.
Tanulási lehetőségek:

- In vivo kísérleti módszerek (pl. miRNS-ekkel való kezelés, plazma/szövetmintavétel)
- In vitro módszerek (pl. western blot, RNS-izolálás, qRT-PCR)
- szövettani módszerek (pl. fixálás, metszés, festési módszerek, RNAscope)
2. A protectomiRs koncepciójának in vivo bizonyítási vizsgálatai
Projekt vezetők: Dr. Makkos András, Szabó Márt
Ezekben a vizsgálatokban új vagy korábban azonosított protektomiR-ek (miRNS-ek) kardioprotektív hatását kívánjuk feltárni és bizonyítani a szívinfarktus és szívelégtelenség egérmodelljében. Emellett célunk a szövetspecifikus célgén-expressziós profil változásainak jellemzése is mind a szívben, mind a különböző szövettípusokban.
Tanulási lehetőségek:
- In vivo kísérleti módszerek (pl. miRNS-ekkel való kezelés, plazma/szövetmintavétel)
- In vitro módszerek (pl. western blot, RNS-izolálás, qRT-PCR)
- szövettani módszerek (pl. fixálás, metszés, festési módszerek, RNAscope.
3. Kémiailag módosított miRNS mimikák/AntagomiR-ek kifejlesztése
Projekt felelősök: Dr. Makkos András, Szabó Márt
 A miRNS-alapú farmakoterápiák fejlesztése során kulcsfontosságú kérdés a megfelelő biológiai hozzáférhetőség és szövetspecifikusság biztosítása, miközben minimalizáljuk a gyógyszer potenciális toxicitását. Ennek megfelelően aktívan dolgozunk a szabadalmaztatott kardioprotektív miRNS-szekvenciáink kémiai módosításon alapuló javításán, hogy javítsuk farmakokinetikai tulajdonságaikat és biztonságosságukat.
A miRNS-alapú farmakoterápiák fejlesztése során kulcsfontosságú kérdés a megfelelő biológiai hozzáférhetőség és szövetspecifikusság biztosítása, miközben minimalizáljuk a gyógyszer potenciális toxicitását. Ennek megfelelően aktívan dolgozunk a szabadalmaztatott kardioprotektív miRNS-szekvenciáink kémiai módosításon alapuló javításán, hogy javítsuk farmakokinetikai tulajdonságaikat és biztonságosságukat.
Tanulási lehetőségek:
- In vivo kísérleti módszerek (miRNS-kezelés, plazma/szövetmintavétel)
- In silico modellezés, preparatív kémia
- Sejttenyésztés, sejtkultúra-alapú kísérleti modellek (pl. miRNS-transzfekció, szimulált iszkémiás reperfúziós modell, életképességi vizsgálatok, fluoreszcenciajel-mérés).
- konfokális mikroszkópos képalkotás
- szövettani módszerek (pl. fixálás, metszés, festési módszerek, RNAscope)
- In vitro módszerek (pl. Western blot, RNS-izolálás, qRT-PCR)
4. Újszerű, miRNS mimikákat/AntagomiR-eket tartalmazó vivőanyag-formulák kifejlesztése
Projekt felelős: Dr. Makkos András
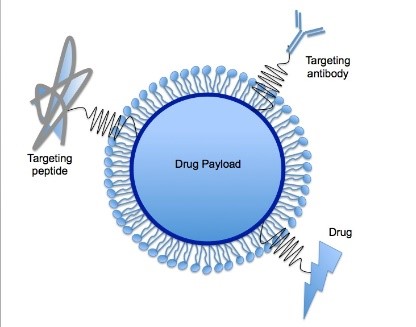 Amint azt korábban említettük, az oligonukleotid-alapú terápiák megfelelő szövetspecifikussága és plazma/szövet felezési ideje nagy kihívást jelent. A kémiai módosításokon túlmenően az innovatív hordozók alkalmazása jelentősen javíthatja a kardioprotektív miRNS-ek farmakokinetikai tulajdonságait (pl. szöveti specifitás, sejtfelvétel).
Amint azt korábban említettük, az oligonukleotid-alapú terápiák megfelelő szövetspecifikussága és plazma/szövet felezési ideje nagy kihívást jelent. A kémiai módosításokon túlmenően az innovatív hordozók alkalmazása jelentősen javíthatja a kardioprotektív miRNS-ek farmakokinetikai tulajdonságait (pl. szöveti specifitás, sejtfelvétel).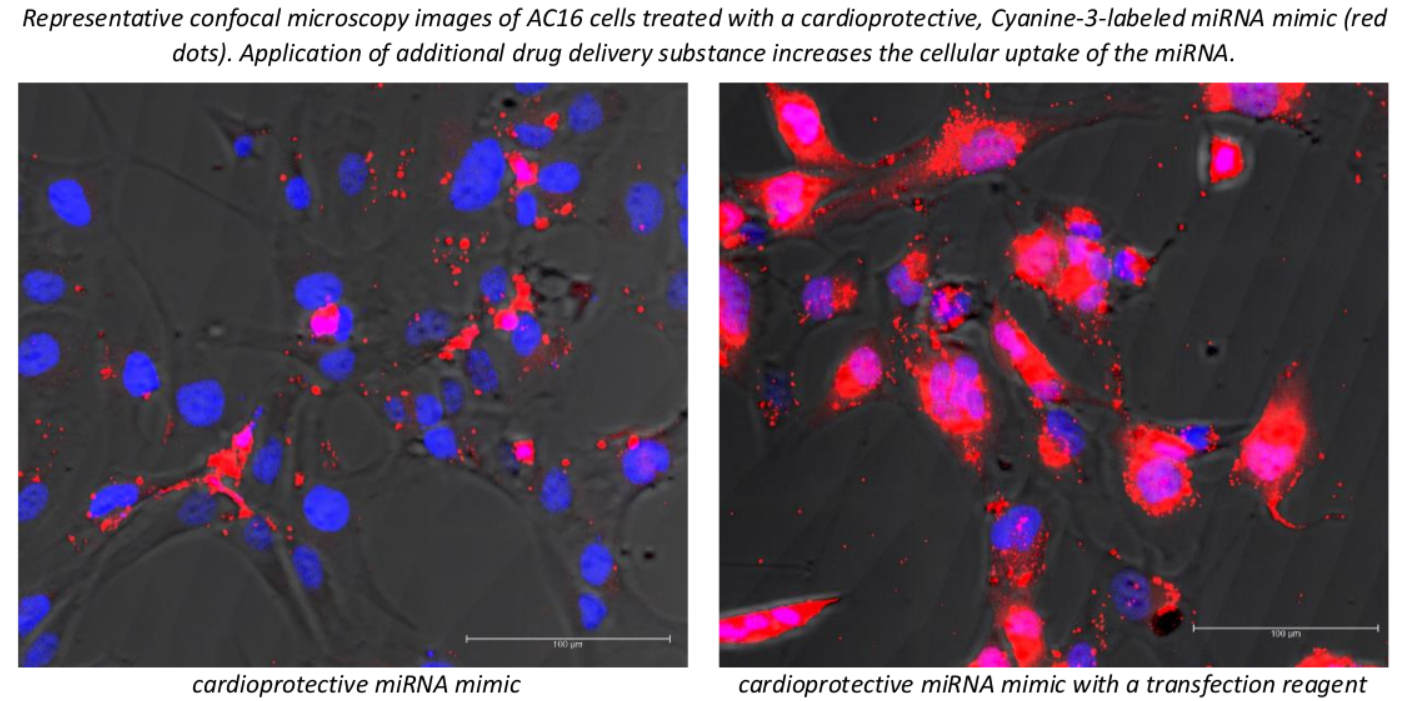
Tanulási lehetőségek:
- Sejttenyésztés, sejtkultúra-alapú kísérleti modellek (pl. miRNS transzfekció, szimulált iszkémiás reperfúziós modell, életképességi vizsgálatok, fluoreszcens jelek mérése).
- Konfokális mikroszkópos képalkotás
- In vivo kísérleti módszerek (oligonukleotidokkal történő kezelés, plazma/szövetmintavétel, szívinfarktus vagy szívelégtelenség egérmodelljei).
- szövettani módszerek (pl. fixálás, metszés, festési módszerek, RNAscope)
Publikációk:
- Makkos, A., Ágg, B., Petrovich, B., Varga, Z. V., Görbe, A., & Ferdinandy, P. (2021). Systematic review and network analysis of microRNAs involved in cardioprotection against myocardial ischemia/reperfusion injury and infarction: Involvement of redox signalling. Free radical biology & medicine, 172, 237–251. https://doi.org/10.1016/j.freeradbiomed.2021.04.034
- Makkos, A., Ágg, B., Varga, Z. V., Giricz, Z., Gyöngyösi, M., Lukovic, D., Schulz, R., Barteková, M., Görbe, A., & Ferdinandy, P. (2021). Molecular Network Approach Reveals Rictoras a Central Target of Cardiac ProtectomiRs. International journal of molecular sciences, 22(17), 9539. https://doi.org/10.3390/ijms22179539
- Varga, Z. V., Zvara, A., Faragó, N., Kocsis, G. F., Pipicz, M., Gáspár, R., Bencsik, P., Görbe, A., Csonka, C., Puskás, L. G., Thum, T., Csont, T., & Ferdinandy, P. (2014). MicroRNAs associated with ischemia-reperfusion injury and cardioprotection by ischemic pre- and postconditioning: protectomiRs. American journal of physiology. Heart and circulatory physiology, 307(2), H216–H227. https://doi.org/10.1152/ajpheart.00812.2013
- Ferdinandy, P., Andreadou, I., Baxter, G. F., Bøtker, H. E., Davidson, S. M., Dobrev, D., Gersh, B. J., Heusch, G., Lecour, S., Ruiz-Meana, M., Zuurbier, C. J., Hausenloy, D. J., & Schulz, R. (2023). Interaction of Cardiovascular Nonmodifiable Risk Factors, Comorbidities and Comedications With Ischemia/Reperfusion Injury and Cardioprotection by Pharmacological Treatments and Ischemic Conditioning. Pharmacological reviews, 75(1), 159–216. https://doi.org/10.1124/pharmrev.121.000348
- Onódi, Z., Visnovitz, T., Kiss, B., Hambalkó, S., Koncz, A., Ágg, B., Váradi, B., Tóth, V. É., Nagy, R. N., Gergely, T. G., Gergő, D., Makkos, A., Pelyhe, C., Varga, N., Reé, D., Apáti, Á., Leszek, P., Kovács, T., Nagy, N., Ferdinandy, P., … Varga, Z. V. (2022). Systematic transcriptomic and phenotypic characterization of human and murine cardiac myocyte cell lines and primary cardiomyocytes reveals serious limitations and low resemblances to adult cardiac phenotype. Journal of molecular and cellular cardiology, 165, 19–30. https://doi.org/10.1016/j.yjmcc.2021.12.007
- Schreckenberg, R., Klein, J., Kutsche, H. S., Schulz, R., Gömöri, K., Bencsik, P., Benczik, B., Ágg, B., Sághy, É., Ferdinandy, P., & Schlüter, K. D. (2020). Ischaemic post-conditioning in rats: Responder and non-responder differ in transcriptome of mitochondrial proteins. Journal of cellular and molecular medicine, 24(10), 5528–5541. https://doi.org/10.1111/jcmm.15209
- Tamargo, J., Agewall, S., Borghi, C., Ceconi, C., Cerbai, E., Dan, G. A., Ferdinandy, P., Grove, E. L., Rocca, B., Sulzgruber, P., Semb, A. G., Sossalla, S., Niessner, A., Kaski, J. C., & Dobrev, D. (2023). New pharmacological agents and novel cardiovascular pharmacotherapy strategies in 2022. European heart journal. Cardiovascular pharmacotherapy, 9(4), 353–370. Advance online publication. https://doi.org/10.1093/ehjcvp/pvad034
- Weber, B. Y., Brenner, G. B., Kiss, B., Gergely, T. G., Sayour, N. V., Tian, H., Makkos, A., Görbe, A., Ferdinandy, P., & Giricz, Z. (2022). Rosiglitazone Does Not Show Major Hidden Cardiotoxicity in Models of Ischemia/Reperfusion but Abolishes Ischemic Preconditioning-Induced Antiarrhythmic Effects in Rats In Vivo. Pharmaceuticals (Basel, Switzerland), 15(9), 1055. https://doi.org/10.3390/ph15091055
- Sághy, É., Vörös, I., Ágg, B., Kiss, B., Koncsos, G., Varga, Z. V., Görbe, A., Giricz, Z., Schulz, R., & Ferdinandy, P. (2020). Cardiac miRNA Expression and their mRNA Targets in a Rat Model of Prediabetes. International journal of molecular sciences, 21(6), 2128. https://doi.org/10.3390/ijms21062128
- Vörös, I., Sághy, É., Pohóczky, K., Makkos, A., Onódi, Z., Brenner, G. B., Baranyai, T., Ágg, B., Váradi, B., Kemény, Á., Leszek, P., Görbe, A., Varga, Z. V., Giricz, Z., Schulz, R., Helyes, Z., & Ferdinandy, P. (2021). Somatostatin and Its Receptors in Myocardial Ischemia/Reperfusion Injury and Cardioprotection. Frontiers in pharmacology, 12, 663655. https://doi.org/10.3389/fphar.2021.663655
- Brenner, G. B., Makkos, A., Nagy, C. T., Onódi, Z., Sayour, N. V., Gergely, T. G., Kiss, B., Görbe, A., Sághy, É., Zádori, Z. S., Lázár, B., Baranyai, T., Varga, R. S., Husti, Z., Varró, A., Tóthfalusi, L., Schulz, R., Baczkó, I., Giricz, Z., & Ferdinandy, P. (2020). Hidden Cardiotoxicity of Rofecoxib Can be Revealed in Experimental Models of Ischemia/Reperfusion. Cells, 9(3), 551. https://doi.org/10.3390/cells9030551
- Spannbauer, A., Traxler, D., Lukovic, D., Zlabinger, K., Winkler, J., Gugerell, A., Ferdinandy, P., Hausenloy, D. J., Pavo, N., Emmert, M. Y., Hoerstrup, S. P., Jakab, A., Gyöngyösi, M., & Riesenhuber, M. (2019). Effect of Ischemic Preconditioning and Postconditioning on Exosome-Rich Fraction microRNA Levels, in Relation with Electrophysiological Parameters and Ventricular Arrhythmia in Experimental Closed-Chest Reperfused Myocardial Infarction. International journal of molecular sciences, 20(9), 2140. https://doi.org/10.3390/ijms20092140
- Sayour, N. V., Brenner, G. B., Makkos, A., Kiss, B., Kovácsházi, C., Gergely, T. G., Aukrust, S. G., Tian, H., Zenkl, V., Gömöri, K., Szabados, T., Bencsik, P., Heinen, A., Schulz, R., Baxter, G. F., Zuurbier, C. J., Vokó, Z., Ferdinandy, P., & Giricz, Z. (2023). Cardioprotective efficacy of limb remote ischaemic preconditioning in rats: discrepancy between a meta-analysis and a three-centre in vivo study. Cardiovascular research, 119(6), 1336–1351. https://doi.org/10.1093/cvr/cvad024
- Schreckenberg, R., Wolf, A., Szabados, T., Gömöri, K., Szabó, I. A., Ágoston, G., Brenner, G., Bencsik, P., Ferdinandy, P., Schulz, R., & Schlüter, K. D. (2022). Proprotein Convertase Subtilisin Kexin Type 9 (PCSK9) Deletion but Not Inhibition of Extracellular PCSK9 Reduces Infarct Sizes Ex Vivo but Not In Vivo. International journal of molecular sciences, 23(12), 6512. https://doi.org/10.3390/ijms23126512
GYÓGYSZER HATÓANYAGOK REJTETT KARDIOTOXIKUS VAGY KARDIOPROTEKTÍV HATÁSÁNAK VIZSGÁLATA
A szívizomzat vérellátásának akut megszűnése az infarktus során visszafordíthatatlan szöveti károsodáshoz és nekrózishoz vezet. Napjainkban a szívizom megmentésére a leghatékonyabb terápia a revaszkularizáció, amelyet vagy trombolízissel, vagy perkután koronária intervencióval (PCI), vagy koronária bypass (CABG) műtéttel végeznek. A véráramlás helyreállítása azonban további szövetkárosodáshoz vezethet. Ezt a jelenséget iszkémia/reperfúziós károsodásnak nevezzük, amely 4 módon jelentkezhet: az infarktusos szövet területének növekedése (lásd az 1. ábrát), megnövekedett mértékű mikrovaszkuláris obstrukció, ritmuszavarok nagyobb valószínűsége, csökkent szívkontraktilitás.
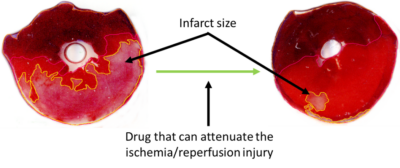
1. ábra: Patkányszív iszkémia/reperfúzión átesett, Evan-kékkel és TTC-vel festett szelete. A bal oldali szeleten a halvány terület az infarktusos szövetet jelöli. Az infarktusos szövet területe egy kardioprotektív gyógyszer alkalmazásával csökkent.
Az iszkémia/reperfúziós károsodás kezelésére még nem áll rendelkezésre engedélyezett gyógyszer, annak ellenére, hogy a területen nagyon intenzív kutatás folyik, azonban jelentős szükség lenne erre az infarktusos betegek akut és hosszú távú túlélésének és/vagy életminőségének javítása érdekében. A projektünkben a szív iszkémiás/reperfúziós sérülésének molekuláris aspektusait vizsgáljuk új farmakológiai célpontok azonosítása érdekében. Továbbá tanulmányozzuk az egyéb betegségek esetén alkalmazott hatóanyagok és az iszkémia/reperfúziós károsodás mértéke közötti kölcsönhatást (a gyógyszerek rejtett kardiotoxicitása), valamint a metabolikus betegségek hatását a kardioprotektív beavatkozásokra és kezelésekre.
1. A gyógyszerek hatása az iszkémia/reperfúziós károsodásra kisállatmodellekben: a rejtett kardiotoxicitás jelentősége
Projektvezetők: Prof. Dr. Ferdinandy Péter, Dr. Görbe Anikó, Dr. Giricz Zoltán
 |
 |
 |
Projekt felelősök: Nagy Regina, Bennet Weber, Dr. Gergely Tamás
 |
 |
 |
A nem várt szívre gyakorolt mellékhatások a klinikai vizsgálatok megszakításának és a gyógyszerek forgalomból való kivonásának legfőbb okai (lásd a 2. ábrát). A 90-es évek közepén végzett első megfigyelések óta jól ismert, hogy a kardiovaszkuláris kockázati tényezők és társbetegségek (mint például az öregedés, a hyperlipidaemia és a cukorbetegség), valamint az ezekre alkalmazott gyógyszerek (pl. nitrát-tolerancia, adenozin-trifoszfát-függő káliumgátló antidiabetikus gyógyszerek, sztatinok stb.) befolyásolhatják a szív iszkémiatűrését és az endogén kardioprotektív jelátviteli utakat. Ezen felül gyógyszerek hatóanyagai a beteg és kezelés alatt álló szívre olyan nemkívánatos hatásokat gyakorolhatnak, amelyek az egészséges szívizomban rejtve maradnak. A rejtett kardiotoxikus hatások hátterében (i) az iszkémia/reperfúziós sérülés és/vagy a rizikófaktorok jelenléte következtében kialakuló szövetkárosító jelátvitel útvonalak gyógyszerek által indukált felerősödése és/vagy (ii) a kardioprotektív túlélési jelátviteli utak gátlása állhat, amelyek iszkémia okozta sejthalálhoz és/vagy pro-aritmiás hatásokhoz vezethetnek. Így határoztuk meg a „rejtett kardiotoxicitás” új fogalmát, amely egy gyógyszer kardiotoxicitását jelenti, amely csak a beteg szívben jelentkezik, pl. iszkémiás/reperfúziós károsodással és/vagy a főbb társbetegségek jelenlétében. A rejtett kardiotoxicitás mechanizmusáról keveset tudunk, ráadásul nem mutatható ki a rutinszerűen alkalmazott, preklinikai, egészséges állatokon vagy szöveteken végzett szívbiztonsági vizsgálati módszerekkel. Ezért célunk a szívbetegségek (különösen a szívizom iszkémiája/reperfúziója és az iszkémiás kondicionálás) kombinált kísérleti in vivo és in vitro modelljeit tartalmazó új szívbiztonsági vizsgálati platform kifejlesztése a főbb szív- és érrendszeri társbetegségek és/vagy társkezelések jelenlétében és hiányában (Ferdinandy et al, European heart
journal, 2018).
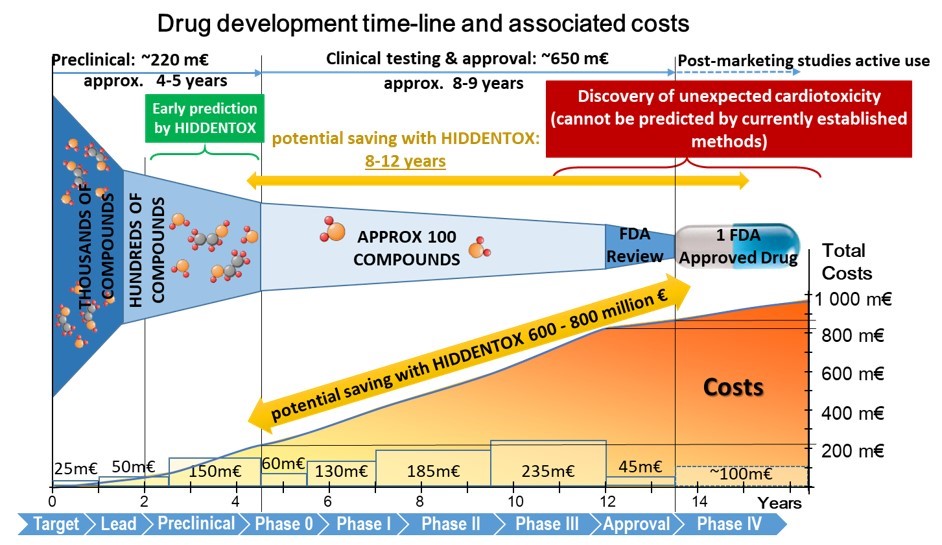
2. ábra: A gyógyszerfejlesztés költségei annak különböző fázisaiban. (Módosítva: Ferdinandy et al. Eur Heart J, 2018)
Tanulási lehetőségek:
- irodalomkutatási módszerek,
- in vivo patkányvizsgálatok tervezése,
- kisállatok kezelése,
- szívműtétek elvégzése patkányokon,
- kvantitatív PCR és Western blotok elvégzése,
- az adatok kiértékelése és bemutatása.
Főbb publikációink a témában:
Ferdinandy, P. et al. Definition of hidden drug cardiotoxicity: paradigm change in cardiac safety testing and its clinical implications. Eur Heart J, 2018. (link)
Ferdinandy, P., et al. Interaction of risk factors, comorbidities, and comedications with ischemia/reperfusion injury and cardioprotection by preconditioning, postconditioning, and remote conditioning. Pharmacol Rev, 2014. 66(4): p. 1142-74. (link)
Brenner GB., et al. Hidden Cardiotoxicity of Rofecoxib Can be Revealed in Experimental Models of Ischemia/Reperfusion. Cells. 2020 Feb 26;9(3):551. (link)
Weber BY, et al. Rosiglitazone Does Not Show Major Hidden Cardiotoxicity in Models of Ischemia/Reperfusion but Abolishes Ischemic Preconditioning-Induced Antiarrhythmic Effects in Rats In Vivo. Pharmaceuticals (Basel). 2022 Aug 26;15(9):1055. (link)
Gergely TG, et al. Effects of Bempedoic Acid in Acute Myocardial Infarction in Rats: No Cardioprotection and No Hidden Cardiotoxicity. Int J Mol Sci. 2023 Jan 13;24(2):1585. (link)
2. Gyógyszerek hatása az iszkémia/reperfúziós károsodásra in vitro sejtkultúra modellekben
Projektvezető: Dr. Görbe Anikó
Projektfelelősök: Bennet Weber, Nagy Regina, Szabó Márta
Korábban bemutattuk, hogy a gyógyszerjelöltek biztonságosságát és rejtett kardiotoxikus hatását in vitro sejtkultúra-modellekben lehet vizsgálni, amelyekben az iszkémia/reperfúziós (I/R) károsodás és a társbetegségek szimulációja megvalósítható. A szívsejtvonalak és a primer izolált szívsejtek nagy áteresztőképességű gyógyszer-szűrésre használhatók, és alkalmazásuk előnyös a gyógyszerek szívsejtekregyakorolt közvetlen hatásainak felmérésére. Projektünkben olyan szereket tesztelünk, amelyek csak olyan társbetegségek, mint a hiperkoleszterinémia vagy az I/R károsodás jelenlétében mutathatnak közvetlen kardiotoxikus hatást a szívsejtekre.

3. ábra: Sejtkezelési munkálatok a sejtlaborban.
Tanulási lehetőségek:
- irodalomkutatási módszerek,
- in vitro sejtkultúra alapú kísérletek tervezése,
- primer szívsejtek izolálása,
- sejtkultúrák fenntartása,
- a sejtek kezelése különböző hatóanyagokkal,
- sejtéletképességi vizsgálatok elvégzése,
- az adatok kiértékelése és bemutatása.
Főbb publikációink a témában:
Brenner GB., et al. Hidden Cardiotoxicity of Rofecoxib Can be Revealed in Experimental Models of Ischemia/Reperfusion. Cells. 2020 Feb 26;9(3):551. (link)
Weber BY, et al. Rosiglitazone Does Not Show Major Hidden Cardiotoxicity in Models of Ischemia/Reperfusion but Abolishes Ischemic Preconditioning-Induced Antiarrhythmic Effects in Rats In Vivo. Pharmaceuticals (Basel). 2022 Aug 26;15(9):1055. (link)
3. A szívre gyakorolt rejtett hatást mutató gyógyszerek által kiváltott transzkriptomikai változások vizsgálata
Projektvezető: Dr. Görbe Anikó
Projektfelelősök: Bennet Weber, Nagy Regina
Az endogén kardioprotektív folyamatok és molekulák jól ismertek a miokardiális iszkémia/reperfúziós (I/R) károsodás csökkentésében, amelyek hatásai gyakran elvesznek a klinikai transzláció során, különösen társbetegségek jelenlétében. Ezenkívül számos gyógyszer miokardiális mellékhatásokat/rejtett kardiotoxicitást mutathat, amelyre a jelenlegi gyógyszerfejlesztési gyakorlatban nem derül fény. A rejtett kardiotoxicitásban a génexpresszió változásai is szerepet játszhatnak, de ez jelenleg egy nem teljesen feltárt terület, és kutatásuk a biztonsági farmakológia új aspektusa. Projektünkben a szívizom mikroRNS és mRNS expressziós profilját kívánjuk vizsgálni egy bizonyítottan kardiotoxikus gyógyszerrel kezelt patkány akut I/R modellben, amely számos differenciálisan expresszálódó célmolekula felfedezését teszi lehetővé. A feltárt expressziós változások alapján azonosíthatók a mellékhatásokért felelős mechanizmusok is. A kiválasztott mikroRNS-ek potenciális toxikus vagy védő hatása validálható I/R rendszerben humán szívizomsejt modellben is. A bioinformatikai elemzés során előre jelzett molekuláris célpontok transzkript- és fehérjeszinten is validálhatók.
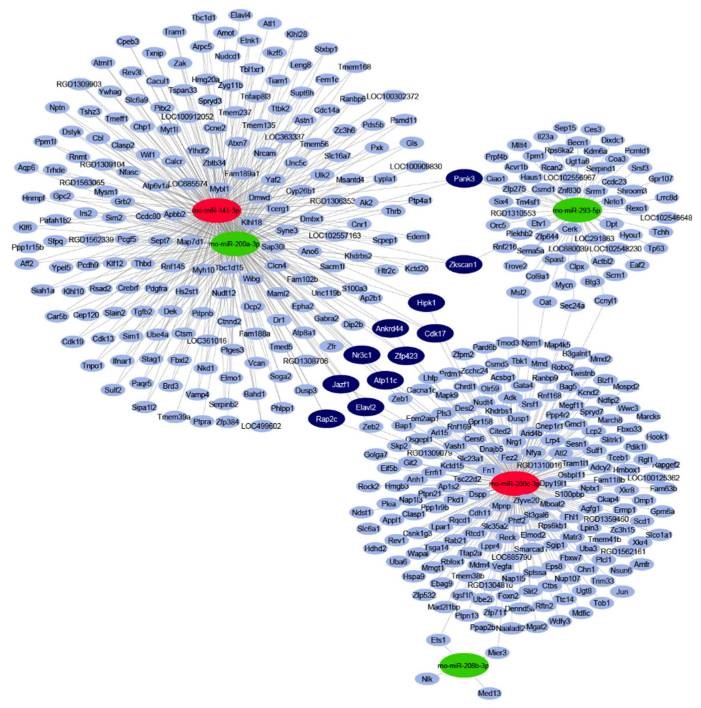
4. ábra: Downregulált (zöld) és upregulált (piros) miRNS-ek interakciós hálózata és kardiális miRNS célpont predikció analízise patkány prediabétesz modellben.
Tanulási lehetőségek:
- irodalomkutatási módszerek,
- in vitro sejtkultúra alapú kísérletek tervezése,
- sejtkultúrák fenntartása,
- a sejtek kezelése különböző hatóanyagokkal,
- miRNS célpont keresés és validálás kvantitatív PCR-rel és Western blottal,
- az adatok kiértékelése és bemutatása.
Főbb publikációink a témában:
Sághy É, et al. Cardiac miRNA Expression and their mRNA Targets in a Rat Model of Prediabetes. Int J Mol Sci. 2020 Mar 20;21(6):2128. (link)
A SZÍV- ÉS ÉRRENDSZERI BETEGSÉGEK METABOLIKUS TÁRSBETEGSÉGEI
1. A metabolikus betegségek hatása az iszkémia/reperfúziós károsodás elleni kardioprotektív beavatkozásokra és kezelésekre
Projektvezetők: Prof. Dr. Ferdinandy Péter, Dr. Görbe Anikó
 |
 |
Projektfelelősök: Dr. Makkos András, Dr. Gergely Tamás, Nagy Regina
 |
 |
 |
Az anyagcserezavarok, mint például az elhízás vagy a cukorbetegség, a szív- és érrendszeri betegségek fő kockázati tényezői. Az egészséges szív képes alkalmazkodni az iszkémiás károsodásához bizonyos mértékben (pl. szívinfarktus során), de az anyagcsere-betegségek, mint például a hiperkoleszterinémia, negatívan befolyásolják a szívnek ezt az iszkémiatoleranciáját, és növelhetik az iszkémia/reperfúzió által érintett károsodás mértékét. A metabolikus társbetegségek miatt a szívizomban bekövetkező változások mechanizmusa nem teljesen ismert, részletesebb megismerésük lehetővé tenné új kardioprotektív terápiák kifejlesztését, ami az iszkémiás szívbetegségek jobb prognózisához vezetne. Tanszékünkön a hiperkoleszterinémia modelljeként a magas zsírtartalmú diétával táplált, altatott patkányokon infarktust okozunk a korszerű kisállat-műtéti létesítményünkben (1. ábra) egy olyan sebészeti eljárással, ahol a bal oldali leszálló koszorúeret öltéssel 30-45 percre elzárjuk, majd felszabadítjuk. A műtét alatt monitorozzuk a vitális paramétereket (pl. vérnyomás, EKG, hőmérséklet, légzés; 2. ábra). Egyetemi hallgatóink megtanulhatják a műtéti technikákat, és aktívan részt vehetnek a folyamatban lévő vizsgálatainkban.

1. ábra: Kisállat műtéti eszközök a Farmakológiai Intézetben.
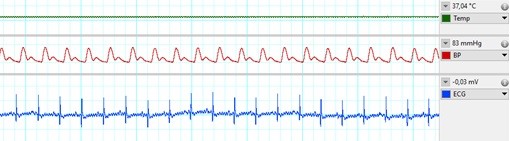
2. ábra: Vitális paraméterek az in vivo iszkémiás/reperfúziós műtét során. Fentről: testhőmérséklet, vérnyomás a központi artériában, EKG.
Tanulási lehetőségek:
- irodalomkutatási módszerek,
- in vivo patkányvizsgálatok tervezése
- anyagcsere-betegségmodellekkel való munka patkányokon,
- kisállatok kezelése,
- szívműtétek elvégzése patkányokon,
- kvantitatív PCR és Western blotok elvégzése,
- az adatok kiértékelése és bemutatása.
Főbb publikációink a témában:
Andreadou I, Daiber A, Baxter GF, Brizzi MF, Di Lisa F, Kaludercic N, Lazou A, Varga ZV, Zuurbier CJ, Schulz R, Ferdinandy P. Influence of cardiometabolic comorbidities on myocardial function, infarction, and cardioprotection: Role of cardiac redox signaling. Free Radic Biol Med. 2021 Apr;166:33-52.
Andreadou I, Tsoumani M, Vilahur G, Ikonomidis I, Badimon L, Varga ZV, Ferdinandy P, Schulz R. PCSK9 in Myocardial Infarction and Cardioprotection: Importance of Lipid Metabolism and Inflammation. Front Physiol. 2020 Nov 12;11:602497. doi: 10.3389/fphys.2020.602497. PMID: 33262707; PMCID: PMC7688516.
Andreadou I, Schulz R, Badimon L, Adameová A, Kleinbongard P, Lecour S, Nikolaou PE, Falcão-Pires I, Vilahur G, Woudberg N, Heusch G, Ferdinandy P. Hyperlipidaemia and cardioprotection: Animal models for translational studies. Br J Pharmacol. 2020 Dec;177(23):5287-5311
Andreadou I, Iliodromitis EK, Lazou A, Görbe A, Giricz Z, Schulz R, Ferdinandy P. Effect of hypercholesterolemia on myocardial function, ischemia-reperfusion injury and cardioprotection by preconditioning, postconditioning and remote conditioning. Br J Pharmacol. 2017 Jun; 174 (12):1555-1569. (link)
Pavo N, Lukovic D, Zlabinger K, Zimba A, Lorant D, Goliasch G, Winkler J, Pils D, Auer K, Jan Ankersmit H, Giricz Z, Baranyai T, Sárközy M, Jakab A, Garamvölgyi R, Emmert MY, Hoerstrup SP, Hausenloy DJ, Ferdinandy P, Maurer G, Gyöngyösi M. Sequential activation of different pathway networks in ischemia-affected and non-affected myocardium, inducing intrinsic remote conditioning to prevent left ventricular remodeling. Sci Rep.2017 Mar 7;7:43958.. (link)
Nagy CT, Koncsos G, Varga ZV, Baranyai T, Tuza S, Kassai F, Ernyey AJ, Gyertyán I, Király K, Oláh A, Radovits T, Merkely B, Bukosza N, Szénási G, Hamar P, Mathé D, Szigeti K, Pelyhe C, Jelemenský M, Onódi Z, Helyes Z, Schulz R, Giricz Z, Ferdinandy. Selegiline reduces adiposity induced by high-fat, high-sucrose diet in male rats. Br J Pharmacol. 2018 Sep;175(18):3713-3726. (link)
Koncsos G, Varga ZV, Baranyai T, Boengler K, Rohrbach S, Li L, Schlüter KD, Schreckenberg R, Radovits T, Oláh A, Mátyás C, Lux Á, Al-Khrasani M, Komlódi T, Bukosza N, Máthé D, Deres L, Barteková M, Rajtík T, Adameová A, Szigeti K, Hamar P, Helyes Z, Tretter L, Pacher P, Merkely B, Giricz Z, Schulz R, Ferdinandy P. Diastolic dysfunction in prediabetic male rats: Role of mitochondrial oxidative stress. Am J Physiol Heart Circ Physiol. 2016 Oct 1;311(4):H927-H943. (link)
Baranyai, T., et al., Acute hyperglycemia abolishes cardioprotection by remote ischemic perconditioning. Cardiovasc Diabetol, 2015. 14: p. 151.

3. ábra: Szív ultrahangvizsgálat és szívnyomás-térfogat elemzés a kisállat műtéti eszközökkel.
2. A hiperkoleszterinémia hatása a makrofágok inflammaszóma-aktivációjára
Projektvezetők: Dr. Görbe Anikó, Dr. Varga Zoltán
Projektfelelős: Nagy Regina
A hiperkoleszterinémia koleszterinfelhalmozódást indukál az immunsejtekben, például a makrofágokban is, ami a Toll-szerű receptor (TLR) jelátvitel és az inflammaszóma aktivációja révén elősegíti a gyulladás kialakulását. Az intracelluláris koleszterinfelhalmozódás és az ebből következő gyulladásos válasz valószínűleg előnyös a fertőzésekre adott válaszreakcióban, azonban súlyosbítja a krónikus gyulladással járó betegségeket, például az ateroszklerózist. A gyulladás számos kardiovaszkuláris betegség kialakulásában, progressziójában és megjelenésében is kritikus szerepet játszik. Az inflammaszómák közvetlen gátlása, a proinflammatorikus citokinek szisztémás gátlása nélkül, hatékony gyulladáscsökkentő kezelés lehet. Így az inflammaszóma-aktiváció mögött álló molekuláris mechanizmusok feltárása új potenciális gyógyszercélpontok felfedezéséhez vezethet a hiperkoleszterinémiás kardiovaszkuláris társbetegségek esetében. Projektünkben azt vizsgáljuk, hogy az in vitro hiperkoleszterinémiás kezelés milyen hatással van a humán monociták/makrofágok gyulladásos mechanizmusaira.
Tanulási lehetőségek:
- irodalomkutatási módszerek,
- metabolikus betegségmodellekkel való munka sejtkultúrákon,
- in vitro sejtkultúrás kísérletek tervezése,
- sejtkultúrák fenntartása,
- sejtek kezelése gyógyszerhatóanyagokkal,
- kvantitatív PCR és Western blotok kivitelezése,
- az adatok kiértékelése és bemutatása
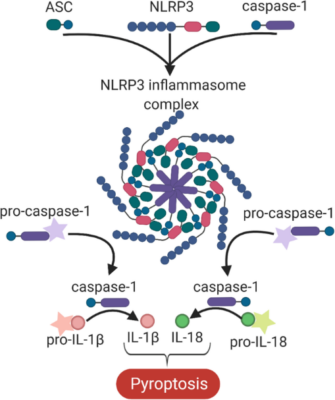
4. ábra: Az NLRP3 inflammaszóma komplex.
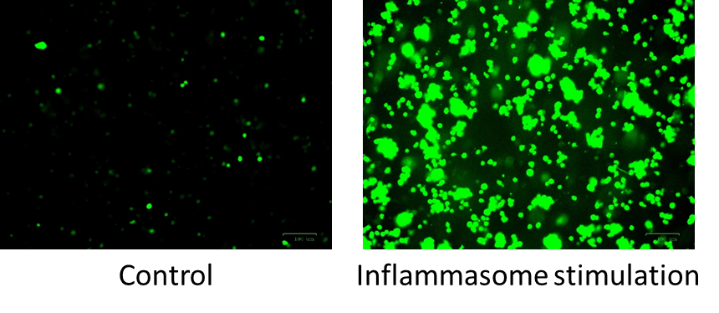
5. ábra: Fluoreszcens felvételek THP1-ASC-GFP monocitákról flagellinnel való inflammaszóma-stimulációt követően.
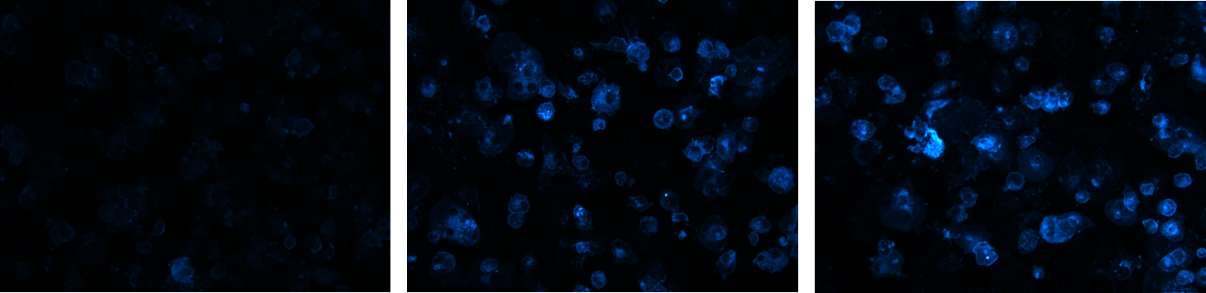
6. ábra: Fluoreszcens felvételek THP1-ASC-GFP sejtek koleszterinfelvételéről különböző koncentrációjú hiperkoleszterinémiás adalékokkal történő kezelést követően.
Tagok
Munkacsoport vezető:
Dr. Görbe Anikó, PhD
Kutatók / posztdoktorok:
Somogyi Orsolya
Dr. Makkos András, PhD
Dr. Sághy Éva, PhD
PhD hallgatók:
Nagy Regina
Szabó Márta
Dr. Weber Bennet
Asszisztensek:
Petrovics Tünde
Horváth László, PhD
Szalai Orsolya
Reyad Ali








