Projektek
Gyulladásos és immunológiai folyamatok vizsgálata kardiovaszkuláris megbetegedésekben
A krónikus szívelégtelenség prognózisa a modern terápiás eszközök és gyógyszerek mellett is igen rossz, a betegek mintegy fele a diagnózist követő 5 éven belül meghal. A betegség kezelése igen nagy terhet ró az egészségügyi rendszerekre. A szívelégtelenség számos okból jöhet létre, de kialakulása során a szívizomzat szerkezete és funkcionalitása károsodik. Leggyakoribb okok közé az iszkémiás szívbetegség, genetikai és gyógyszer indukálta (leggyakrabban tumor ellenes kemoterápiák) kardiomiopátiák tartoznak, de aritmiák és billentyűbetegségek is okozhatják a kialakulását. Az eltérő etiológia ellenére a szívelégtelenség progressziójaban fontos szerepet játszanak mind celluláris (neutrophil granulociták, makrofágok, B és T limfociták) mind pedig humorális gyulladásos folyamatok, gyulladáskeltő citokinek, neuropeptidek, így az IL-1β, IL-18 vagy a TNF-α, melyek jelentősen fokozzák a szívizomzat károsodását.
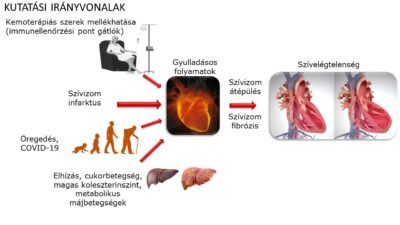
Vizsgálataink célja ezen sejttípusok és a különböző humorális faktorok terápiás modulálásának vizsgálata különböző szívelégtelenség modellekben és in vitro sejtalapúkísérletes rendszereken.
1. Gyulladásos folyamatok vizsgálata metabolikus betegségekhez (elhízás, cukorbetegség, hiperkoleszterinémia, májcirrhózis) és öregedéshez társuló szívizom diszfunkció kialakulásában
Projektfelelős: Dr. Tóth Viktória, Dr. Varga Zoltán
A szívelégtelenség a vezető halálokok közé tartozik világszerte. Klinikailag két markánsan elkülönülő formában jelentkezhet a betegség: csökkent ejekciós frakcióval (HFrEF) vagy megtartott ejekciós frakcióval (HFpEF). A szívelégtelenségben szenvedő betegek közel felénél HFpEF jelentkezik, azaz az ejekciós frakció megtartott. Ezek a betegek általában idősek és gyakran több társbetegségben szenvednek (pl.: diabétesz, elhízás, hiperkoleszterinémia). Sok esetben a betegek nem reagálnak jól a HFrEF kezelése során használt gyógyszerekre (digitálisz, ACE gátló, β-blokkoló), emiatt igen jelentős az ezen a területen történő gyógyszerfejlesztés. A HFpEF-et jellemzi ezen felül a magas mortalitás (65% -os 5 éves mortalitás).
HFpEF kialakulásának molekuláris mechanizmusa kevéssé ismert, jobb megértése a betegség kimenetelének javítása érdekében viszont elengedhetetlen. Feltételezhető, hogy a kardiális diszfunkcióhoz hozzájárulhat egy szisztémás gyulladásos állapot, azonban ennek oki szerepe még nem bizonyított. Jelenlegi ismereteinket tovább korlátozza ezen komplex betegség állatkísérletes modellezésének nehézsége.
Célunk, olyan új állatmodellek kifejlesztése és vizsgálata, melyek a HFpEF transzlációs vizsgálatát lehetővé teszik.
Elsajátítható technikák:
- munka kísérleti állatokkal,
- hisztológiai technikák, immunohisztokémia,
- RNS és fehérje munkák – Western blot, qRT-PCR
Referenciák:
-
Valenta I*, Varga ZV*, Valentine H, Cinar R, Horti A, Mathews WB, Dannals RF, Steele K, Kunos G, Wahl RL, Pomper MG, Wong DF, Pacher P, Schindler TH. Feasibility Evaluation of Myocardial Cannabinoid Type 1 Receptor Imaging in Obesity: A Translational Approach. JACC Cardiovasc Imaging. 2018 Feb;11(2 Pt 2):320-332. [IF: 10.189] *-megosztott elsőszerzőség
-
Varga ZV, Kupai K, Szűcs G, Gáspár R, Pálóczi J, Faragó N, Zvara A, Puskás LG, Rázga Z, Tiszlavicz L, Bencsik P, Görbe A, Csonka C, Ferdinandy P, Csont T.: MicroRNA-25-dependent up-regulation of NADPH oxidase 4 (NOX4) mediates hypercholesterolemia-induced oxidative/nitrative stress and subsequent dysfunction in the heart. J Mol Cell Cardiol. 2013. 62:111-21. [IF: 5.218]
2. Kardio-onkológia és Onko-kardiológia
Projektfelelős: Gergely Tamás, Nabil Sayour, Kovács Tamás, Dr. Varga Zoltán
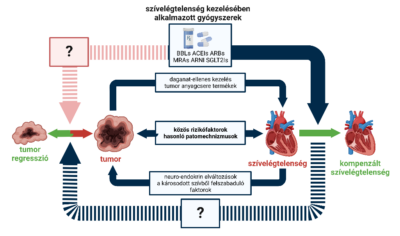
A szív- és érrendszeri, valamint a daganatos megbetegedések gyakran kéz a kézben járnak, és egyazon betegben alakulnak ki. A két betegségcsoport a világon bekövetkező összes haláleset közel feléért felelős, így nem meglepő, hogy kitüntetett figyelem övezi a két súlyos kórállapot egyidejű előfordulását. A kardiovaszkuláris és onkológiai betegségek közös rizikófaktorokkal rendelkeznek, hasonló patomechanizmusokon keresztül alakulhatnak ki, de bizonyos esetekben közös genetikai háttérrel is rendelkezhetnek, nem beszélve az alkalmazott kezelések esetleges mellékhatásairól. Ezzel foglalkozik a kardio-onkológia tudományterülete.
Az elmúlt évtizedekben jelentős előrelépés történt a daganatellenes terápiákban. Az immunterápiák bevezetése számottevően javította az onkológiai betegek túlélését. Az immunellenőrzőpont-gátlók (ICI) az immunterápiáknak a leggyakrabban alkalmazott típusát képviselik. Ezek a monoklonális antitestek az immunsejtek aktiválódásának tumor általi gátlását fordítják vissza és így egy fokozott adaptív immunválasz segítségével elősegítik a rákos sejtek elpusztítását. Jelentőségüket mutatja, hogy a CTLA-4 és PD-1 receptorok felfedezéséért James P. Allison és Tasuko Honjo 2018-ban átvehették az orvosi Nobel-díjat.

Az immunrendszer aktiválása a fent említett módon nem specifikus, az ICI-terápia a nem daganatos szövetekben is az immunsejtek túlaktiválódását válthatja ki, ezáltal immunkapcsolt mellékhatásokhoz (irAE) vezethetnek. A legritkábban jelentkező, viszont egyben legsúlyosabb mellékhatás a szívizomgyulladás és a szívelégtelenség.
Fő célkitűzésünk a ritka mellékhatásként megjelenő szívizomkárosodás hátterében álló folyamatok megismerése. Ezáltal új diagnosztikus és terápiás célpontok azonosítása, melyek befolyásolásával csökkenteni lehet az immunellenőrzőpont-gátlók káros mellékhatásának előfordulását, súlyosságát. Különös hangsúlyt fektetünk a csecsemőmirigyben aktiválódó gyulladásos sejtek szerepének tanulmányozására, szerepükre a toxicitás kialakításában (1). Céljaink közt szerepel az immunellenőrzőpont-gátlók kardiotoxikus mellékhatásának kezelése mellett olyan kombinációs kezelési eljárás kidolgozása is, mely a tumorválaszt nem befolyásolja, sőt akár a tumorellenes hatást fokozni tudja.
Projektek:
-
Tumoros betegség és szívelégtelenség egymásra gyakorolt hatásának vizsgálata
-
Tumorellenes terápia indukálta szívelégtelenség vizsgálata és befolyásolási lehetőségei
A szívelégtelenség önmagában is nehezen befolyásolható, hosszan tartó betegség, amely különböző okok miatt alakulhat ki. Számtalan gyógyszert használnak a kezelésére, azonban a betegek életkilátásai rosszak, így további új és hatékony gyógyszerekre van szükség. Kutatócsoportunk állatkísérletek segítségével modellezi a szívelégtelenséget és új gyógyszercélpontokat keres.
Projektek:
-
Gyógyszer-indukálta szívizom diszfunkció modell és farmakológiai befolyásolási lehetőségeinek vizsgálata
-
Nyomástúlterheléses szívelégtelenség modellben a szívelégtelenség terápiás lehetőségeinek vizsgálata
-
Az korosodás hatásai a gyógyszer-indukálta szívelégtelenségre
Bizonyos szívbetegségek (pl. a fent említett szívelégtelenség is) már önmagában egy onkogén környezetet jelentenek, ami emeli a daganat megjelenésének rizikóját. Az ilyen fordított megközelítést, ahol a szívből származó faktoroknak a daganatra gyakorolt hatását vizsgáljuk, reverz onko-kardiológiának hívjuk. Kutatócsoportunk vizsgálatokat végez annak kiderítése érdekében, hogy a szívelégtelenség vagy a szívelégtelenség farmakoterápiája fokozza-e a daganatképződés rizikóját, illetve a kialakuló daganatok növekedése hogyan változik már fennálló szívelégtelenség esetén, és ezek hátterében milyen molekuláris folyamatok állhatnak. Ezen betegcsoportok számára új kezelési ajánlásokat kívánunk megfogalmazni.
Projektek:
-
A szívelégtelenség hatása a tumornövekedésre
-
A szívelégtelenség farmakoterápiájának hatása a tumornövekedésre
Elsajátítható módszerek, technikák:
- in vitro sejttenyésztés és kísérleti rendszerek
- spektrális áramlási citometria, immunfenotipizálás
- munka kísérleti állatokkal
- in vivo tumormodellek létrehozása, vizsgálata
- tumornövekedés monitorozása képalkotó technikák segítségével (tumorszkenner, ultrahang, in vivo fluoreszcencia és biolumineszcencia alapú vizsgálatok)
- hisztológiai technikák, immunhisztokémia, immunfluoreszcencia
-
A témában megjelent közleményeink:Gergely TG, Kucsera D, Tóth VE, et al. Characterization of immune checkpoint inhibitor-induced cardiotoxicity reveals interleukin-17A as a driver of cardiac dysfunction after anti-PD-1 treatment. Br J Pharmacol. 2023;180(6):740-761. doi:10.1111/bph.15984
Tagok
Munkacsoport-vezető:
Kutatók/posztdoktorok:
Dr. Tóth Viktória, PhD
Szabó Lilla
Kovács Tamás
Gelencsérné Kulin Anna
Dr. Köhler Zoltán Márton, PhD
PhD hallgatók:
Dr. Gergely Tamás
Dr. Sayour Viktor Nabil
Dr. Jakab Márk
Kocsis Márton
Hegedűs Zsombor
Dr. Ayham Alhaddad
Asszisztensek:
Farkas Szabolcs
Kovács Andrea
Képek





