Projektek
Gyulladásos és immunológiai folyamatok vizsgálata kardiovaszkuláris megbetegedésekben
A krónikus szívelégtelenség prognózisa a modern terápiás eszközök és gyógyszerek mellett is igen rossz, a betegek mintegy fele a diagnózist követő 5 éven belül meghal. A betegség kezelése igen nagy terhet ró az egészségügyi rendszerekre. A szívelégtelenség számos okból jöhet létre, de kialakulása során a szívizomzat szerkezete és funkcionalitása károsodik. Leggyakoribb okok közé az iszkémiás szívbetegség, genetikai és gyógyszer indukálta (leggyakrabban tumor ellenes kemoterápiák) kardiomiopátiák tartoznak, de aritmiák és billentyűbetegségek is okozhatják a kialakulását. Az eltérő etiológia ellenére a szívelégtelenség progressziójaban fontos szerepet játszanak mind celluláris (neutrophil granulociták, makrofágok, B és T limfociták) mind pedig humorális gyulladásos folyamatok, gyulladáskeltő citokinek, neuropeptidek, így az IL-1β, IL-18 vagy a TNF-α, melyek jelentősen fokozzák a szívizomzat károsodását.
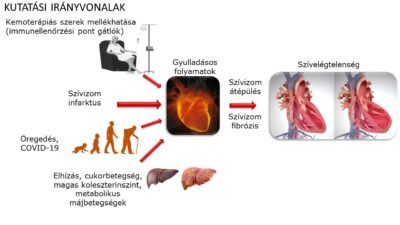
Vizsgálataink célja ezen sejttípusok és a különböző humorális faktorok terápiás modulálásának vizsgálata különböző szívelégtelenség modellekben és in vitro sejtalapúkísérletes rendszereken.
1.1. Különböző gyulladásos mechanizmusok (inflammaszóma priming és aktiváció, DNS szenzor útvonalak) szerepe és terápiás befolyásolási lehetőségei szívbetegségekben
Projektfelelős: Dr. Onódi Zsófia, Dr. Mórotz Gábor, Dr. Varga Zoltán
Az IL-1β felszabadulást az inflammaszómák szabályozzák. Az inflammaszómák olyan multiprotein-komplexek, amelyeket különböző immunsejtek expresszálnak, és amelyek a citokinek, pl. az IL-1β és az IL-18 hasítását és felszabadulását indukálják. Amikor patogén- vagy veszély-asszociált minták jelennek meg, az immunsejtek az inflammaszóma fehérjéket fokozottan expresszálják, hogy felkészüljenek az immunválaszra (a jelenséget inflammaszóma „priming”-nak nevezik). Ha az intracelluláris inflammaszóma szenzorok (mint például az NLRP3, NLRC4 vagy AIM2) felismerik a specifikus mintázatokat, az inflammaszómák oligomerizálódnak, és aktiválják a kaszpáz-1 enzimet, ami a citokinek hasításához vezet (ezt nevezik inflammaszóma „aktiválásnak” vagy „triggerelésnek”). Korábbi vizsgálataink azt mutatták, hogy az inflammaszómák jelentős szerepet játszhatnak a HF patomechanizmusában, mivel az AIM2 és az NLRC4 inflammaszóma szenzorok fokozott fehérjeexpresszióját találtuk a szívelégtelen (HF) betegekből származó humán szívmintákban, amit az IL-1β kimutatásával is megerősítettünk [1, 2]. Továbbá kimutattuk, hogy a probenecid – egy klinikailag alkalmazott köszvényelleni gyógyszer – jelentős gyulladáscsökkentő, különösen inflammaszóma inhibitor hatással rendelkezik in vitro és in vivo modellekben [1]. Irodalmi adatok szerint [3] a probenecid a pannexin-1 csatorna gátlásán keresztül a purinerg szignalizáció modulálásával hathat, amely gátolhatja az inflammaszóma primingot és aktivációt is. Még mindig nem ismert azonban, hogy a probenecid és más inflammaszóma inhibitorok pontosan mely lépés(ek)et gátolhatják.
Célok:
-
Szívizomdiszfunkciós és szívelégtelen állatmodellek segítségével karakterizálni a gyulladásos útvonalak változásait a szívben és más szövetekben.
-
Komplex in vitro gyógyszer-szűrési platform létrehozása az inflammaszóma inhibitorok tesztelésére,
-
Hatóságok által már engedélyezett gyógyszerek tesztelése a létrehozott in vitro platformon további in vivo vizsgálatok céljából.
Elsajátítható képességek, módszerek:
– in vitro protein és nukleinsav alapú módszerek: Western blot, ELISA, qRT-PCR,
– hisztológiai eljárások (rutin hisztológiai festések, immunhisztológia, immunfluoreszcencia),
– RNS in-situ hibridizáció (RNAscope), konfokális mikroszkópia, áramlási citometria,
– sejtkultúra kezelés,
– állatkísérletek és műtéti eljárások,
1.2. Immunszervek (csontvelő, lép, thymus) morfológiai és funkcionális változásai szívbetegségekben – mechanizmusok vizsgálata és terápiás lehetőségek
Projektfelelős: Dr. Onódi Zsófia
A gyulladásos és immunsejtek homeosztázisának fő helyszínei a vérképző- és immunszervek, mint például a csontvelő, a lép, a thymus és a nyirokcsomók. Számos tanulmány áll rendelkezésre a HF-betegek és állatok szívének vagy plazmájának fokozott gyulladásos aktivitásáról, azonban az extrakardiális szervek gyulladásos útvonalainak megváltozása és következményei kevésbé ismertek [4]. Évek óta ismert, hogy a szívbetegségek, mint például az előrehaladott HF, összefüggésben állnak a vérképzőszervi rendellenességekkel, beleértve az anémiát vagy a leukociták megváltozott számát, amelyek rosszabb prognózissal járnak együtt [5, 6]. Nemrégiben arról számoltak be, hogy a szívbetegségek jelentős változásokat indukálhatnak a csontvelőben, amelyek befolyásolhatják a vér- és immunsejtek termelését, ami fokozott gyulladáshoz vezethet [7]. Annak ellenére, hogy egyre több publikáció foglalkozik a szívelégtelenséghez társuló immun- és vérképzőszervi diszfunkcióval, nem áll rendelkezésre elegendő adat a pro-inflammatorikus környezet hatásairól szívbetegségekben. Ezért a jövőben szükség van a hematopoetikus szervek gyulladásos aktivitásának részletes jellemzésére.
Célok:
-
a gyulladásos folyamatok vizsgálata a szívben és az olyan immunszervekben, mint csontvelő, thymus és lép,
-
különböző etiológiájú (pl. transzverzális aorta-szűkület vagy gyógyszer okozta) HF egér- és patkánymodellekből származó immunszervekben a gyulladásos útvonalak aktivitásának változásainak felmérése.
Kísérletes megközelítés, elsajátítható módszerek:
- Állatmodellek: A kísérlethez patkányokat vagy egereket használunk. Különböző módszerekkel szívizomkárosodást és így szívizomdiszfunkciót okozunk, pl. infarktust, aortaszűkítéssel nyomástúlterheléses szívelégtelenséget vagy kardiotoxikus gyógyszerekkel szívizomkárosodást hozunk létre. Az állatokat meghatározott ideig utánkövetjük, vérmintákat gyűjtünk tőlük és a szívfunkciót echokardiográfiával vizsgáljuk, végül szövetmintákat gyűjtünk tőlük.
- Sejtkultúra modellek: A gyógyszerek potenciális inflammaszóma inhibitor hatásának vizsgálatára a következő kísérleteket végezzük in vitro. THP1 natív vagy ASC-GFP riporter sejtvonalakat használunk az inflammaszóma fehérjék expressziójának stimulálására (priming) és az inflammaszóma aktivációjának kiváltására. A kezelés után a sejteket és a felülúszókat leszedjük, homogenizáljuk vagy képalkotó eljárásokra előkészítjük.
- Hisztológia, immunhisztokémia és -fluoreszcencia: Klasszikus szövettani festést alkalmazunk a szervi fibrózis és a zsírlerakódások jelenlétének értékelésére. A sejtfelszíni markerek és intracelluláris fehérjék expressziójának értékelését, valamint kolokalizációs vizsgálatokat végzünk szöveti metszeteken. Klasszikus mikrószkópos eljárásokkal vagy konfokális mikroszkópiával történik a képalkotás.
- In vitro molekuláris és biokémiai mérések: A sejtek jelátviteli változásait, a fehérje- és citokinszinteket, az enzimaktivitásokat Western blot, qRT-PCR, ELISA, citokin array vagy enzimaktivitási próbák segítségével határozzuk meg.
Referenciák:
1. Onodi, Z., et al., AIM2-driven inflammasome activation in heart failure. Cardiovasc Res, 2021. 117(13): p. 2639-2651.
2. Kugler, S., et al., Inflammasome activation in end-stage heart failure-associated atrial fibrillation. ESC Heart Fail, 2022. 9(4): p. 2747-2752.
3. Onodi, Z., et al., Drug repurposing for cardiovascular diseases: New targets and indications for probenecid. Br J Pharmacol, 2023. 180(6): p. 685-700.
4. Li, H., C. Chen, and D.W. Wang, Inflammatory Cytokines, Immune Cells, and Organ Interactions in Heart Failure. Front Physiol, 2021. 12: p. 695047.
5. Anand, I.S. and P. Gupta, Anemia and Iron Deficiency in Heart Failure: Current Concepts and Emerging Therapies. Circulation, 2018. 138(1): p. 80-98.
6. Sukhbaatar, N. and T. Weichhart, Iron Regulation: Macrophages in Control. Pharmaceuticals (Basel), 2018. 11(4).
7. Rohde, D., et al., Bone marrow endothelial dysfunction promotes myeloid cell expansion in cardiovascular disease. Nat Cardiovasc Res, 2022. 1(1): p. 28-44.
Fig1 – Adamo, L., Rocha-Resende, C., Prabhu, S.D. et al. Reappraising the role of inflammation in heart failure. Nat Rev Cardiol 17, 269–285 (2020). https://doi.org/10.1038/s41569-019-0315-x
Fig2 – Solimando AG, Melaccio A, Vacca A, Ria R. The bone marrow niche landscape: a journey through aging, extrinsic and intrinsic stressors in the haemopoietic milieu. Journal of Cancer Metastasis and Treatment. 2022; 8: 9. http://dx.doi.org/10.20517/2394-4722.2021.166
Tagok
Képek