In der renommierten Fachzeitschrift Nature Communications wurde ein Artikel veröffentlicht, der ausschließlich von Forschern des Instituts für Physiologie verfasst wurde. Die Forschungsgruppe von Dr. Balázs Enyedi, außerordentlicher Professor am Institut, hat eine innovative Methode entwickelt, mit der die Freisetzung eines wichtigen Entzündungsregulators, Leukotrien B4, in lebenden Geweben in Echtzeit mit mikroskopischen Methoden nachgewiesen werden kann.
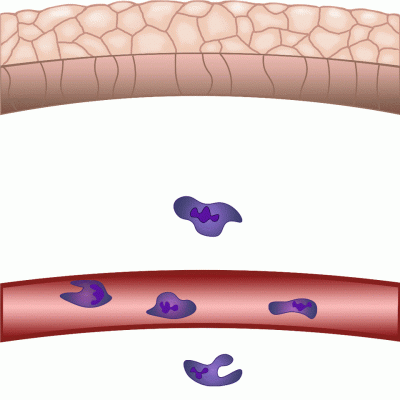
Im Falle einer Gewebeschädigung mobilisiert der Körper innerhalb von Minuten seine Abwehrmechanismen gegen potenzielle Krankheitserreger aus der Außenwelt. Der Nobelpreisträger Ilja Iljitsch Mechnikow beobachtete bei der Untersuchung von Seesternlarven unter dem Mikroskop, dass Zellen nach einer Verletzung in Richtung der Wunde wandern – und entdeckte die Immunzellen, die heute als Phagozyten bekannt sind. Obwohl dieses Phänomen schon seit fast 150 Jahren bekannt ist, sind viele Details dieses fein regulierten Prozesses noch immer nicht gut geklärt. In unseren Experimenten an Zebrafischen verletzen wir die Schwanzflosse der 2-3 Millimeter langen Zebrafischlarven und nutzen die Mikroskopie, um die regulatorischen Prozesse sichtbar zu machen, die es den weißen Blutkörperchen ermöglichen, innerhalb von Minuten zur Wundstelle zu wandern, um den Körper vor Krankheitserregern zu schützen und die Wundkontraktion und anschließende Heilung zu fördern” – erklärt Dr. Balázs Enyedi.
 Die durch chemische Umweltreize ausgelöste Zellbewegung wird als Chemotaxis bezeichnet, und die Moleküle, die die Zellwanderung in Richtung des chemischen Reizes verstärken, werden als Chemoattraktoren bezeichnet. Nach einer Verletzung werden im verletzten Gewebe Chemoattraktoren produziert bzw. freigesetzt, die die Migration weißer Blutkörperchen und eine lokale Entzündung auslösen. Diese Moleküle konnten jedoch nicht in Echtzeit beobachtet werden, wir wussten nicht genau, wann und von welchen Zellen sie freigesetzt wurden, und wir wussten nicht, wie weit sie sich von der Quelle entfernt haben” – sagte der außerordentliche Professor. Die neue Methode besteht darin, dass sie eines der Moleküle, das die Entzündung reguliert, nämlich Leukotrien B4, in Echtzeit sichtbar machen und messen konnten, wodurch es zum ersten Mal möglich war, den Ort und die Gewebeverteilung der Freisetzung eines Chemoattraktivums bei Entzündungen zu untersuchen.
Die durch chemische Umweltreize ausgelöste Zellbewegung wird als Chemotaxis bezeichnet, und die Moleküle, die die Zellwanderung in Richtung des chemischen Reizes verstärken, werden als Chemoattraktoren bezeichnet. Nach einer Verletzung werden im verletzten Gewebe Chemoattraktoren produziert bzw. freigesetzt, die die Migration weißer Blutkörperchen und eine lokale Entzündung auslösen. Diese Moleküle konnten jedoch nicht in Echtzeit beobachtet werden, wir wussten nicht genau, wann und von welchen Zellen sie freigesetzt wurden, und wir wussten nicht, wie weit sie sich von der Quelle entfernt haben” – sagte der außerordentliche Professor. Die neue Methode besteht darin, dass sie eines der Moleküle, das die Entzündung reguliert, nämlich Leukotrien B4, in Echtzeit sichtbar machen und messen konnten, wodurch es zum ersten Mal möglich war, den Ort und die Gewebeverteilung der Freisetzung eines Chemoattraktivums bei Entzündungen zu untersuchen.
Im Grunde haben wir eine neue Brille entwickelt, mit der wir ein wichtiges Molekül, das die Entzündung reguliert, sichtbar machen können
– betonte Dr. Balázs Enyedi.
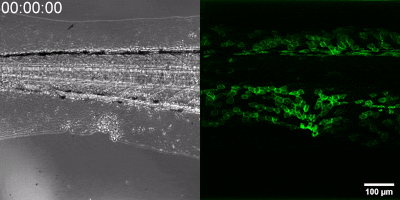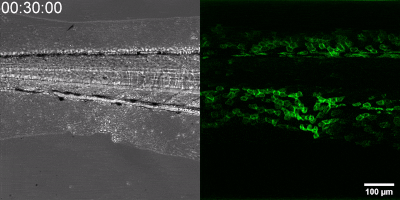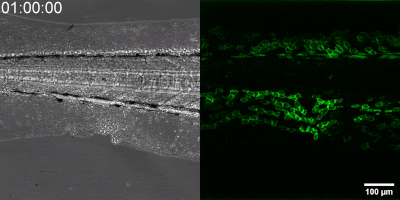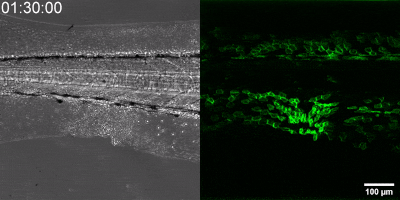 Die neue Methode, die die Gruppe entwickelt hat, besteht darin, einen Biosensor ausgehend vom Leukotrien-B4-Rezeptor durch Veränderung seiner Sequenz herzustellen. Die grüne Fluoreszenz des Sensors erhöht sich durch Leukotrien B4 deutlich und kann unter einem Fluoreszenzmikroskop gemessen werden, wobei die Intensität des grünen Lichts mit der Leukotrien B4-Konzentration variiert (siehe Abbildung). Die DNA-Sequenz, die den Biosensor kodiert, kann in die – während der Experimente getesteten Zellen – eingebracht werden, die dann selbst den Sensor erzeugen. Auf diese Weise können transgene Zebrafische oder sogar Mäuse erzeugt werden, in denen bestimmte Zellen den Sensor exprimieren, was den mikroskopischen Nachweis von Leukotrien B4 in ihrer eigenen Umgebung ermöglicht. Als kleines Molekül diffundiert Leukotrien B4 innerhalb von Minuten von der Quelle weg, so dass es in fixierten Geweben mit klassischen Immunfärbemethoden nicht nachweisbar ist. Mit der neuen Methode kann jedoch die Freisetzung von Leukotrien B4 als grünes Fluoreszenzsignal in transgenen Tieren in Echtzeit überwacht werden” – betonte Dr. Balázs Enyedi.
Die neue Methode, die die Gruppe entwickelt hat, besteht darin, einen Biosensor ausgehend vom Leukotrien-B4-Rezeptor durch Veränderung seiner Sequenz herzustellen. Die grüne Fluoreszenz des Sensors erhöht sich durch Leukotrien B4 deutlich und kann unter einem Fluoreszenzmikroskop gemessen werden, wobei die Intensität des grünen Lichts mit der Leukotrien B4-Konzentration variiert (siehe Abbildung). Die DNA-Sequenz, die den Biosensor kodiert, kann in die – während der Experimente getesteten Zellen – eingebracht werden, die dann selbst den Sensor erzeugen. Auf diese Weise können transgene Zebrafische oder sogar Mäuse erzeugt werden, in denen bestimmte Zellen den Sensor exprimieren, was den mikroskopischen Nachweis von Leukotrien B4 in ihrer eigenen Umgebung ermöglicht. Als kleines Molekül diffundiert Leukotrien B4 innerhalb von Minuten von der Quelle weg, so dass es in fixierten Geweben mit klassischen Immunfärbemethoden nicht nachweisbar ist. Mit der neuen Methode kann jedoch die Freisetzung von Leukotrien B4 als grünes Fluoreszenzsignal in transgenen Tieren in Echtzeit überwacht werden” – betonte Dr. Balázs Enyedi.
 “Die Forschung hat mehrere zukunftsweisende Aspekte. Sie wird uns ein besseres Verständnis der Biologie und Pathologie von Entzündungen ermöglichen: Es gibt viele Forschungsteams, die daran arbeiten und deren Traum es seit Jahrzehnten ist, die Freisetzung und Diffusion von Molekülen nicht nur prinzipiell zu verstehen, sondern diesen Prozess auch sehen zu können. Unsere Methode wird uns ein besseres Verständnis der genauen Rolle der Faktoren ermöglichen, die die Entzündungsbiologie auch in verschiedenen Krankheitsmodellen regulieren – dies kann künftig ein Schlüssel zur Entwicklung wirksamerer therapeutischer Mittel sein. Andererseits bieten die neuen chemoattraktiven Biosensoren, die geschaffen wurden und derzeit entwickelt werden, auch die Möglichkeit, Moleküle und Inhibitoren zu finden, die die Funktion der Chemoattraktoren schneller und effizienter beeinflussen als die derzeitigen Methoden. Derzeit konzentrieren wir uns darauf, die biologische Wirkung von entzündungsregulierenden Molekülen besser zu verstehen, aber längerfristig planen wir auch die Identifizierung von Inhibitoren, die in der pharmazeutischen Forschung eingesetzt werden können”- betonte Dr. Balázs Enyedi.
“Die Forschung hat mehrere zukunftsweisende Aspekte. Sie wird uns ein besseres Verständnis der Biologie und Pathologie von Entzündungen ermöglichen: Es gibt viele Forschungsteams, die daran arbeiten und deren Traum es seit Jahrzehnten ist, die Freisetzung und Diffusion von Molekülen nicht nur prinzipiell zu verstehen, sondern diesen Prozess auch sehen zu können. Unsere Methode wird uns ein besseres Verständnis der genauen Rolle der Faktoren ermöglichen, die die Entzündungsbiologie auch in verschiedenen Krankheitsmodellen regulieren – dies kann künftig ein Schlüssel zur Entwicklung wirksamerer therapeutischer Mittel sein. Andererseits bieten die neuen chemoattraktiven Biosensoren, die geschaffen wurden und derzeit entwickelt werden, auch die Möglichkeit, Moleküle und Inhibitoren zu finden, die die Funktion der Chemoattraktoren schneller und effizienter beeinflussen als die derzeitigen Methoden. Derzeit konzentrieren wir uns darauf, die biologische Wirkung von entzündungsregulierenden Molekülen besser zu verstehen, aber längerfristig planen wir auch die Identifizierung von Inhibitoren, die in der pharmazeutischen Forschung eingesetzt werden können”- betonte Dr. Balázs Enyedi.
Der Forscher absolvierte die Fakultät für Allgemeinmedizin der Semmelweis Universität im Jahre 2006 und promovierte am Institut für Physiologie in der Forschungsgruppe von Dr. Miklós Geiszt, Professor am Institut, über reaktive Sauerstoffderivate. Bereits dort entwickelte Dr. Balázs Enyedi Fluoreszenzsensoren mit denen der Pegel eines der reaktiven Sauerstoffderivate, Wasserstoffperoxid, in Zellen gemessen werden kann. Anschließend erhielt er eine Stelle im Institut für Zellbiologie am Memorial Sloan Kettering Cancer Center in New York, USA. Hier lernte er unter anderem das Modellsystem Zebrafisch kennen.
Ich wurde dem Labor eines jungen Arbeitsgruppenleiters, Dr. Philipp Niethammer, zugewiesen, was für meine Karriere ein besonderer Glücksfall war: Als Postdoc konnte ich den Aufbau eines Labors miterleben und dieses Wissen später selbst nutzen. Von 2011 bis 2016 arbeitete ich in den Vereinigten Staaten, wo ich das Modellsystem Zebrafisch kennenlernte, und kehrte dann an die Semmelweis Universität zurück, wo ich begann, die Infrastruktur für die Zebrafischforschung und die damit verbundene Lebendmikroskopie aufzubauen, die bis dahin an der Institution nicht vorhanden war
– betonte er. Dazu hat er nicht nur von der Semmelweis Universität Unterstützung bekommen: Im Jahre 2018 erhielt er ein Stipendium des Lendület-Programms der Ungarischen Akademie der Wissenschaften, das ihm dank des Startup-Programms der Universität und der Förderprogrammen des Direktorats für Innovation den Aufbau seiner Forschungsgruppe am Institut für Physiologie ermöglichte. “Während ich in den USA ein gut gewartetes, fertiges System hatte, musste ich hier zu Hause von Null anfangen: von der sorgfältigen architektonischen Gestaltung des Tierhauses über das Beleuchtungssystem bis hin zum Lebensraum für die Zebrabärblinge musste alles gemeinsam mit meinem Team erarbeitet werden”, erklärt er und fügt hinzu: Während seiner Jahre als Forscher in den USA veröffentlichte er Artikel in Nature Cell Biology, einer der renommiertesten Zeitschriften, sowie in Cell und erhielt so das Vertrauen, seine Forschung in Ungarn fortsetzen zu können. Als junger Arbeitsgruppenleiter wurde er auch als Stipendiat in das ungarische Exzellenzzentrum für molekulare Medizin (HCEMM) aufgenommen, in dem er Mitglied ist und in enger Zusammenarbeit mit dem Europäischen Labor für Molekularbiologie in Heidelberg tätig sein kann.
 Die Ergebnisse des Teams wurden in der renommierten Fachzeitschrift Nature Communications veröffentlicht, die über einen Impact-Faktor von 15-20 verfügt. Obwohl die Publikation schnell von der Zeitschrift zugelassen wurde, waren viele Jahre nötig, bis sie so weit gekommen sind. “Das Team, mit dem ich zusammenarbeite, ist aber für mich wichtiger als das Mikroskopsystem, die Instrumente und die Zebrafischmodelle. Zurzeit sind wir zu zehnt: drei Doktoranden, zwei MD-PhD-Studenten, zwei Postdoktoranden und zwei Labor- und Tierhausleiter, darunter französische und deutsche Forscher. Unser Team ist also nicht nur enthusiastisch und jung, sondern auch international”, – sagte Dr. Balázs Enyedi und fügte hinzu, dass sie von mehreren TDK-Studenten unterstützt werden, mit denen es eine besondere Freude ist, zusammenzuarbeiten.
Die Ergebnisse des Teams wurden in der renommierten Fachzeitschrift Nature Communications veröffentlicht, die über einen Impact-Faktor von 15-20 verfügt. Obwohl die Publikation schnell von der Zeitschrift zugelassen wurde, waren viele Jahre nötig, bis sie so weit gekommen sind. “Das Team, mit dem ich zusammenarbeite, ist aber für mich wichtiger als das Mikroskopsystem, die Instrumente und die Zebrafischmodelle. Zurzeit sind wir zu zehnt: drei Doktoranden, zwei MD-PhD-Studenten, zwei Postdoktoranden und zwei Labor- und Tierhausleiter, darunter französische und deutsche Forscher. Unser Team ist also nicht nur enthusiastisch und jung, sondern auch international”, – sagte Dr. Balázs Enyedi und fügte hinzu, dass sie von mehreren TDK-Studenten unterstützt werden, mit denen es eine besondere Freude ist, zusammenzuarbeiten.
Einer der denkwürdigsten Momente auf dem Weg zur Publikation war, als er den Prototyp ihres Leukotrien-B4-Sensors vor einem Jahr, wenige Tage vor Weihnachten, zum ersten Mal in Betrieb sah. Danach mussten sie fast drei Jahre lang arbeiten, um die Freisetzung von Leukotrien B4 aus weißen Blutkörperchen in einem Zebrafisch-Tiermodell erfolgreich messen zu können. Hierbei lag die größte Schwierigkeit: Aufgrund von Fachliteraturdaten wurde erwartet, dass die Freisetzung von Leukotrien B4 über viele Monate hinweg in einem anderen Zeitfenster erfolgt, so dass man lange Zeit dachte, es gäbe ein Problem mit dem System, weil die Messungen zu kurzfristig gemacht wurden.
Wie Dr. Balázs Enyedi sagte, sind ihre Leistungen von vielen Menschen im In- und Ausland beglückwünscht worden. Vor der Veröffentlichung in Nature Communications hatte er seine Forschung bereits auf mehreren Konferenzen vorgestellt, was bereits viel Aufmerksamkeit und Interesse erregt hatte – und dieses Interesse hat sich dank der Veröffentlichung in dieser angesehenen Zeitschrift noch verstärkt. “Das Werkzeug kann von vielen Leuten in ihren eigenen Experimenten verwendet werden, und es gab bereits mehrere Anfragen aus Amerika, Deutschland und England” – betonte er. Dr. Balázs Enyedi fügte hinzu, dass die Veröffentlichung für sein Forschungsteam erst der Anfang ist, der den Weg zeigt, den sie in den nächsten 5-10 Jahren begehen wollen.
Ádám Szabó
Photo: Attila Kovács – Semmelweis Universität
Übersetzung: Judit Szlovák