A sejtbiológia és a neuronok világa iránti különleges érdeklődése vezette Vörös Kingát egy jelenleg még gyógyíthatatlan idegrendszeri betegség, a Huntington-kór neuronális hátterének kutatásához. A Semmelweis Egyetem Transzlációs Medicina Intézet PhD-hallgatója munkájában egy kalciumcsatorna-blokkoló gyógyszer hatékonyságát teszteli az intézetükben kifejlesztett indukált neuronális modellel, összehasonlítva a párhuzamosan zajló preklinikai és a klinikai vizsgálati fázis eredményeit. Munkájáért az idei évben Semmelweis Innovációs Díjat vehetett át a leginnovatívabb PhD-értekezés kategóriában.
 A gyógyítás világa már gyermekkorától érdekelte Vörös Kingát, aki magát tősgyökeres kolozsvárinak vallja, de több éve Budapestre költözött gyógyszervegyész-mérnöki tanulmányai miatt, és jelenleg a Semmelweis Egyetem Transzlációs Medicina Intézetében, a HCEMM-SE Neurobiológiai és Neurodegeneratív Betegségek Kutatócsoportban kutat. Szülővárosában erős kémia és biológia alapokra építve biomérnökként szerzett ismereteket az élő szervezetek kémiai folyamatairól, gyógyszerek fejlesztéséről, gyógyszerhatásról, tesztelésről. „Az akkor tanultakat mind a mai napig tudom használni a napi munkában” – emelte ki a Semmelweis PhD-hallgató kutatója.
A gyógyítás világa már gyermekkorától érdekelte Vörös Kingát, aki magát tősgyökeres kolozsvárinak vallja, de több éve Budapestre költözött gyógyszervegyész-mérnöki tanulmányai miatt, és jelenleg a Semmelweis Egyetem Transzlációs Medicina Intézetében, a HCEMM-SE Neurobiológiai és Neurodegeneratív Betegségek Kutatócsoportban kutat. Szülővárosában erős kémia és biológia alapokra építve biomérnökként szerzett ismereteket az élő szervezetek kémiai folyamatairól, gyógyszerek fejlesztéséről, gyógyszerhatásról, tesztelésről. „Az akkor tanultakat mind a mai napig tudom használni a napi munkában” – emelte ki a Semmelweis PhD-hallgató kutatója.A sejtbiológia iránti szenvedélye az egyetem előtt kezdődött, amikor egy hathetes ösztöndíjat nyert az egyesült államokbeli Arizonai Egyetemre, ahol számos kutatólabort megismerhetett. Mindez nagy hatással volt arra, hogy hazatérve a rákkutatás került érdeklődése fókuszába. Egyetemi diplomamunkájában egy vérpótló szer sejtszintű, rákellenes hatását vizsgálta.
A kutatás világában szerzett ipari és intézeti tapasztalatok után PhD-képzésre jelentkezett a Semmelweis Egyetemre, ahol közelebbi kapcsolatba kerülhetett a neuronok világával. Dr. Pircs Karolina, a Transzlációs Medicina Intézet HCEMM-SE Neurobiológiai és Neurodegeneratív Betegségek Kutatócsoport tudományos főmunkatársának kutatásai jelentősen motiválták, hogy bekapcsolódjon a csoport és az intézet munkájába, aki laborvezetője és PhD témavezetője lett –, és akit szakmai példaképnek is tekint.
A rákkutatás nagyon szép terület, de a neurális hálózatok, a neuronok működése – ahogy általuk gondolkodunk, ahogy végigmegy az impulzus az idegsejteken, nyúlványokon, továbbá az idegrendszeri betegségek kutatása – ez egy nagyon másfajta világ. Sokfajta neurodegeneratív betegségről tudunk, és az öregedéssel kapcsolatos kutatás is nagyon fontos lett számomra. Úgy éreztem, hogy erre kell most koncentrálnom
– világította meg döntése hátterét.
Kutatásuk egy eredetileg magasvérnyomás-betegség kezelésére kifejlesztett kalciumcsatorna-blokkoló gyógyszernek a Huntington-kór esetében a terápiás célú alkalmazási lehetőségeit vizsgálja egy különleges preklinikai modellben. A készítmény az 1980-as évek óta van forgalomban, állatmodelleken végzett kísérletes alkalmazásáról ismertek szakirodalmi adatok, és kellő ideje használják a klinikai gyógyászatban ahhoz, hogy hatásait jól ismerjék, így alkalmas lehet gyógyszer újra felhasználásra a Huntington-kóros betegekben.
Vizsgálatuk középpontjában egy klinikai és egy preklinikai kísérlet összehasonlítása áll a Cambridge-i Egyetemmel együttműködésben – vázolta fel. A felodipin gyógyszer újra felhasználási teszteléséhez 18 Huntington-kóros betegből és 7 egészséges kontrollból álló kohorszot választottak ki. A Semmelweis labor a teljes kohorszból származó fibroblaszt (bőrminta) sejteket programozta át közvetlen módon indukált neuronokká (iN) úgy, hogy a kapott idegsejtek megtartják a donor genetikai és korfüggő jellemzőit. A páciensek Cambridge-ben egy évig kapták a vérnyomáscsökkentő készítményt, és vizsgálták a szer tolerálhatóságát és biztonságosságát. Ezzel párhuzamosan a Semmelweisen a fibroblasztokból létrehozott indukált neuronokon ugyanennek a gyógyszernek a hatását tesztelték: hogyan hat sejtszinten, hogyan változnak a különböző funkciók, különös tekintettel az autofágia (sejten belüli lebontó folyamat) mechanizmusára.
A Huntington-kór jellegzetessége, hogy a korábban egészséges páciens neuronsejtjeiben a betegség beálltával elindul egy fokozott öregedési folyamat, amely bizonyos neuronok elhalásához vezet, ami a betegek kognitív, motoros, érzékelési, egyensúlyi zavarait okozza. A folyamat nem visszafordítható, jelenleg nem ismert a gyógymódja, csak a tünetek kezelhetőek. Az idegsejtekben, más neurodegeneratív betegségekhez hasonlóan, mint az Alzheimer- vagy a Parkinson-kór esetén, megfigyelhető egy felgyorsult öregedés. Ezen kívül a neuronokban nem megfelelően működik az autofágia, egy fontos, evolúciósan konzervált lizoszómális lebontó folyamat, ezáltal felgyülemlenek az agy egyes területein káros fehérjék, amelyek aggregálódnak.
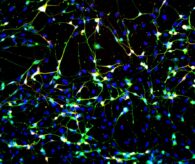
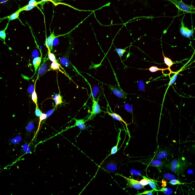
A humán bőrsejtből csupán 4 hét alatt átprogramozott indukált neuronok hasonló felépítésűek, mint az agy neuronjai: sejttestből és nyúlványokból állnak. Mikroszkóp alatt láthatóvá és a többi sejttől elkülöníthetővé válnak neuronokra specifikus festést követően (zölden fluoreszkálnak). Egy speciális berendezéssel tudják megmérni az idegsejtek különböző morfológiai jellemzőit, amelyet aztán összehasonlítanak az egészséges kontrollszemélyek eredményeivel.
A kutató elmondta, a tervezett kísérleti szakaszt mostanra nagyjából lezárták, jelenleg a szabadalmi eljáráson és az adatok publikálásán dolgoznak. Ezekről részletesebben a megjelenést követően biztosan hallhatunk majd – fűzte hozzá. A cél az, hogy a modellükkel segítsék a klinikai kutatásokat, a gyógyszerteszteléseket, javítva azok hatékonyságát, ami a Huntington-kór esetében rendkívül alacsony: 3 százalék körüli a 3-as fázisban lévő gyógyszerkísérletek sikerességi aránya. „A jövőben terveink között szerepel több neurodegeneratív betegségre, például az Alzheimer- és Parkinson-kórra is kiterjeszteni a kutatásainkat” – fűzte hozzá.
Jólesnek az elismerések, szakmai visszajelzések – mondta el, kitérve arra is, hogy mostanában épp egy rangos németországi konferenciára hívták meg. Hozzátette, a sejtbiológiai kutatás nem egyszerű mesterség, a sok öröm mellett nehézségek is adódnak, amikor a sejtek nem azt teszik, amit a kutató szeretne, vagy bármilyen apróság miatt újra kell kezdeni egy hetekig tartó folyamatot. „Neuronokkal dolgozni a legnehezebb, hiszen érzékeny, nem osztódó sejtek, nagy gonddal kell kezelni őket. Úgy szoktam mondani, hogy ők a gyerekek, tisztába tesszük, tápláljuk őket, talán még az is számít, mit gondolunk, teszünk mellettük, és nincs olyan, hogy úgy megyünk haza, hogy nem gondoskodunk róluk; tulajdonképpen mindig először ők esznek, aztán mi” – adott betekintést a sejtlaborok világába.
Kutatói munkám itt a Semmelweisen az, amire mindig is vágytam, nagyon releváns a téma, kézzelfogható az eredmény és a kimenet. Dolgoztam már többfajta kutatási területen, de úgy érzem, itt közvetlenül láthatom, hogyan hasznosul a munkánk, hogy ezzel embereken segíthetünk
– foglalta össze Vörös Kinga.
Tasnádi Róbert
Fotó: Zellei Boglárka – Semmelweis Egyetem
Fotó: Zellei Boglárka – Semmelweis Egyetem
A cikket a Semmelweis Egyetem Kommunikációs Igazgatósága tette közzé.