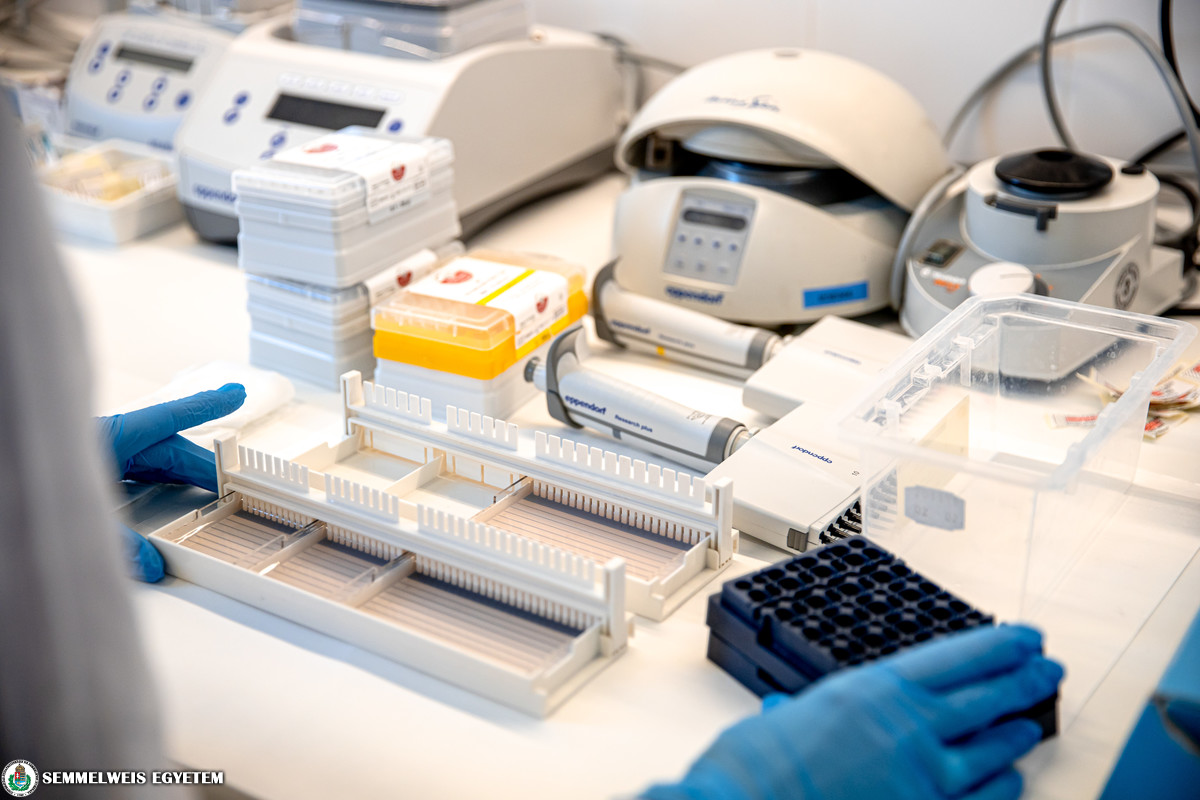
A program első molekuláris vizsgálatait 2019-ben végezték dr. Alpár Donát vezetésével, kezdetben alapítványi és hálózati támogatással, majd egyedi méltányossági kérelemre meghozott Nemzeti Egészségbiztosítási Alapkezelői döntések adták a finanszírozási hátteret, 2022 januárja óta azonban valamennyi leukémiás gyerek számára elérhető az újgenerációs szekvenálással végzett genetikai profilozás teljeskörű állami támogatás mellett – mondta dr. Bödör Csaba, egyetemi tanár, a Patológiai és Kísérleti Rákkutató Intézet molekuláris diagnosztikai részlegének vezetője. Szavai szerint a klinikus kollégákkal közösen kezdeményezték a program indulását. Ez egy centralizált molekuláris tesztelési program: az ország összes leukémiás gyermekének mintáját a Semmelweis Egyetemre küldik a gyermekonkológiai centrumok, ahol évente frissített, saját tervezésű génpanelek alapján elemzik az eredményeket.
Ennél bővebb a Magyar Gyermekonkológiai Profilozási Program, mivel annak keretében nemcsak a hematológiai megbetegedésekben, hanem egyéb szolid tumorok esetében is készül 500 gén vizsgálatával komprehenzív genomikai profilozás. Ezt elsősorban a terápiás döntések megalapozásához, célzott terápiák elindításához kérik az onkológusok. Bizonyos esetekben pedig patológusokkal közreműködve a diagnózisok pontosításában is segítenek ezek a vizsgálatok. Itt nagyon szorosan együttműködik a molekuláris labor a Semmelweis Egyetem Gyermekgyógyászati Klinikájával, valamint a Magyar Gyermekonkológiai Hálózat további klinikai centrumaival. Az elmúlt években többször is elsőként sikerült leírni egy-egy genetikai eltérés hatását adott gyermekkori daganattípus esetén, és azok a betegek a célzott terápiára már jól reagáltak. Eddig mindegy 150 gyermek esetében végezték el az átfogó genomikai profilalkotási vizsgálatot.
Összességében a gyermekkori tumoroknál a betegeink 25 százaléka kap valamilyen célzott terápiát az NGS-vizsgálatokat követően – jegyezte meg dr. Bödör Csaba.
Évente nagyjából 60-70 akut limfoid leukémiás gyermeket diagnosztizálnak Magyarországon. Esetükben a kezelőorvos kérésére elvégezhető az a mintegy 102 génre koncentráló vizsgálat, amely alapján bizonyos génváltozatok, eltérések megléte esetén személyre szabott terápiával segíthető a gyógyulás. Az akut mieloid leukémia ritkább, évi 5-8 beteget azonosítanak, diagnosztizálásánál 59 gén eltéréseit vizsgálják. A leukémiás gyerekek genomikai kivizsgálása során elvégzett harmadik vizsgálattípusnál pedig transzkriptomikai vizsgálatot végeznek, és már mintegy 1385 génre kiterjedően vizsgálják a vérmintákat, ilyenkor génfúziók meglétét is vizsgálják. Ezen vizsgálathoz szükséges az Országos Molekuláris Onkoteam támogató döntése. A program és az együttműködés révén elvégzett analízisek színvonala a világon bárhol megállja a helyét – mondta dr. Bödör Csaba.
A kisebb, 300 gén alatti paneleket alkalmazó vizsgálatok az egyetemi centrumok keretéből is finanszírozhatóak, míg az ennél több gén esetleges eltéréseit feltáró NGS vizsgálatok finanszírozásáról egyedi kérelmek alapján dönt a NEAK, az Országos Molekuláris Onkoteam javaslata alapján. Ilyen vizsgálatot a kezelőorvos kezdeményezésére három intézmény végezhet Magyarországon: a Semmelweis Egyetem, a Pécsi Tudományegyetem és az Országos Onkológiai Intézet. Gyermekek esetében amennyiben klinikailag indokolt a genetikai profilozás bármilyen tumoros megbetegedés esetén – vannak ugyanis olyan kórképek is, amelyeknél nem szükséges az 500 génes vizsgálat, mert ennél kevesebbet vizsgálva is meghatározható a szükséges kezelési irány a komprehenzív genetikai profilozásra vonatkozó nemzetközi ajánlások alapján – általában engedélyezi a nagyobb génpaneles vizsgálatok elvégzését és egyszeri finanszírozását a NEAK.
A limfoid leukémia esetében 85 százalékos az ötéves túlélési esély, a mieloid kórkép esetében ennél némiképp rosszabb esélyekkel számolhatnak a betegek. Egyébként az 1970-es évek óta átlagosan mintegy 65 százalékkal javultak a leukémiás betegek öt éves túlélési esélyei, és ebben a diagnosztikai és terápiás előrelépések mellett komoly szerepe volt a gyermekonkológiai hálózat működésének is – jegyezte meg dr. Bödör Csaba. A páciensek nagy része jól reagál a standard kezelési protokollra is, de akiknél ez nem így van, azok esetében nagy szükség van új terápiás célpontokra, stratégiákra. Ezeknél a magas rizikójú betegeknél van kiemelt jelentősége az onkogenomikai vizsgálatoknak.
Előfordul persze olyan eset is, amikor nem található olyan eltérés, amelyre létezne alkalmazható célzott terápia – hívta fel a figyelmet dr. Bödör Csaba.
Az eljárás során a beteg legfrissebb vér- és csontvelőmintáját elküldik az egyetemre, ahol abból nukleinsavat izolálnak, ebből újgenerációs szekvenálással DNS-t és RNS-t is vizsgálnak, meghatározva a legfontosabb genetikai eltéréseket, pontmutációkat és génfúziókat. A szekvenálás, vagy a génfúziók elemzését is tartalmazó vizsgálat leletei – melyek készítésében molekuláris biológusok, molekuláris patológusok, klinikai genetikus és PhD-hallgatók is részt vesznek – általában 3 hét alatt készülnek el, ezt követően a klinikusokkal is konzultálnak. A profilozás eredményeképp prognosztikus és prediktív biomarkereket azonosítanak, amelyek segítik a kezelőorvost annak megítélésében, hogy a molekuláris eltérések hogyan befolyásolják a kezelési stratégiát, a beteg kaphat-e, és ha igen, milyen célzott terápiát.
Az indulás óta már közel 260 leukémiás páciens molekuláris profilja készült el, a minták a biobankba kerültek, és ennek köszönhetően ezeket a gyermekeket nemzetközi klinikai vizsgálatokba is bevonhatják, vagyis egyúttal óriási adatkincset is jelent a program” – emelte ki dr. Bödör Csaba.
Ez már akkora adatmennyiség, amely megfelelő értékeléséhez döntéstámogató szoftverek és mesterséges intelligencia napi használata is szükséges. A kutatócsoport mindenesetre saját, naprakész, strukturált és a későbbiekben betegre is kereshető adatbázist készít az általuk végzett onkogenomikai, illetve egyéb célú NGS-vizsgálatok eredményeiről, amely a későbbi kutatásokhoz is felhasználható lesz. Az NGS-laborban egyébként évi több mint 3 ezer mintát vizsgálnak meg – beleértve az onkohematológiai, és a szolid tumorokhoz és kardiogenetikához kapcsolódó megkereséseket is, az egyetemi klinikákon túl legalább 20 külső, részben az onkohematológiai hálózatban részt vevő klinika részéről is. Az NGS-vizsgálatokon felül 2022-ben további 17 ezer molekuláris biológiai vizsgálatot végeztek a munkatársaival. Az elmúlt években folyamatosan bővült a labor tevékenysége, lassan feszegetjük a határainkat az egyre újabb klinikai igények hatására – jegyezte meg dr. Bödör Csaba.
Mindezeknek köszönhetően a közelmúltban két D1-es közlemény is megjelent a gyermekleukémiai adatok felhasználásával készült kutatások eredményeiről. Az egyikben dr. Krizsán Szilvia és kutatótársai a 2003-2021 között akut mieloid leukémiával diagnosztizált 75 gyermek genetikai profilját és túlélési paramétereit publikálták a The Journal of Molecular Diagnostics folyóiratban. A másik közlemény azt részletezi, hogy dr. Alpár Donát, az intézet tudományos főmunkatársának vezetésével, valamint dr. Bedics Gábor PhD hallgató és dr. Egyed Bálint rezidens társelsőszerzőségével a British Journal of Cancer folyóiratban jelent meg, a kutatócsoport tagjai egy hazai adatokra épülő, nemzetközi adatokkal is validált új rizikóbecslő módszert dolgoztak ki akut limfoid leukémiában – ismertette dr. Bödör Csaba. A fenti programok megvalósításában több éve kiemelt szerepet tölt be továbbá Dr. Péterffy Borbála PhD hallgató is.
Azon túlmenően, hogy egyre újabb tumortípusok esetében azonosítsanak terápiás célra is hasznosítható genetikai eltéréseket, a gyermekonkológiai kutatások másik fő iránya, hogy a hagyományos szövetmintákon alapuló diagnosztika mellett a folyadékbiopsziás mintákból, azaz a perifériás vérben lévő, a tumorsejtekből felszabaduló sejtmentes DNS molekulákat vizsgálják. És bár bizonyos vizsgálatokat már most is el tudnak végezni, a cél a teljes körű genetikai profilozás lenne, ami terápiás célokra alkalmas lehet. Bizonyos vizsgálatokat már jelenleg is likvid biopsziából végeznek el az egyetemi betegellátás során, és nemcsak az onkológia, de a szívtranszplantáció területén is. Ez egy gyorsan fejlődő, izgalmas új kutatási és terápiás terület – tette hozzá dr. Bödör Csaba.
Kiss Melinda Katalin
Fotó: Kovács Attila – Semmelweis Egyetem
A cikket a Semmelweis Egyetem Kommunikációs Igazgatósága tette közzé.