A neutrofil granulocita eredetű mikrovezikulumok immunológiában betöltött új és igen fontos szerepére világít rá a Semmelweis Egyetem kutatóinak publikációja, amely az Amerikai Hematológiai Társaság Blood című folyóiratában jelent meg. Az írást a Blood szerkesztői beválasztották a „legforróbb” témákat taglaló közlemények közé. A kutatási eredmények sokat segíthetnek egy, az antibiotikumoktól eltérő antibakteriális rendszer megértésében, esetleges modulálásában. Alábbiakban dr. Timár Csaba PhD-hallgató, a publikáció első szerzője foglalja össze a publikált kutatási eredményeket.
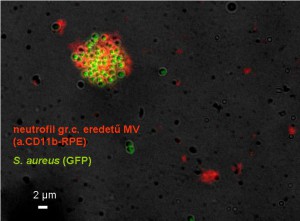 A neutrofil granulociták a falósejtek (fagociták) családjába tartozó fehérvérsejtek, vezető szerepet játszanak a szervezetbe bejutott baktériumok elpusztításában. Élettani jelentőségüket jól mutatja, hogy hiányuk, avagy csökkent működésük ismétlődő fertőzéseket eredményez. A neutrofil granulocita baktériumölésének klasszikus, régóta ismert folyamatának lényege a baktériumok bekebelezése, majd sejten belüli (fagolizoszómában történő) elpusztítása enzimek és reaktív oxigén gyökök segítségével. A fagocitózis azonban feltételezi a baktériumok előzetes „megjelölését”, opszonizációját is, melyet a vérben keringő komplement fehérjék és antitestek végeznek. Az opszonizáció hiányában a neutrofil granulociták sokkal nehezebben ismerik fel a baktériumokat, így jóval kevesebbet tudnak csak elpusztítani közülük.
A neutrofil granulociták a falósejtek (fagociták) családjába tartozó fehérvérsejtek, vezető szerepet játszanak a szervezetbe bejutott baktériumok elpusztításában. Élettani jelentőségüket jól mutatja, hogy hiányuk, avagy csökkent működésük ismétlődő fertőzéseket eredményez. A neutrofil granulocita baktériumölésének klasszikus, régóta ismert folyamatának lényege a baktériumok bekebelezése, majd sejten belüli (fagolizoszómában történő) elpusztítása enzimek és reaktív oxigén gyökök segítségével. A fagocitózis azonban feltételezi a baktériumok előzetes „megjelölését”, opszonizációját is, melyet a vérben keringő komplement fehérjék és antitestek végeznek. Az opszonizáció hiányában a neutrofil granulociták sokkal nehezebben ismerik fel a baktériumokat, így jóval kevesebbet tudnak csak elpusztítani közülük.

Az utóbbi évtized egyik érdekes felismerése, hogy majdnem minden vizsgált sejttípus képes úgynevezett szubcelluláris vezikulák termelésére. Ezek a vezikulák a termelő sejt membránjára jellemző lipid kettősrétegből épülnek fel, és meglehetősen specifikus az összetételük. Képesek nagy távokat megtenni a sejten kívüli térben, így nem meglepő, hogy a sejtek egymás közötti kommunikációjának egy fontos formáját képviselik, kiemelt szerepüket igazolták pl. a tumorok áttétképzésében. Méretük alapján szokás csoportosítani őket: a legkisebbek az exoszómák (átmérő kb. 100 nm), a nagyobbak mikrovezikulumok (MV, átmérő kb. 500-800 nm), a legnagyobbak az apoptotikus testek (1-3 μm).
A Blood folyóiratban megjelent közleményben összefoglalt eredmények lényege, hogy a neutrofilek különböző stimulusra különböző összetételű és funkciójú mikrovezikulumokat termelnek. Amennyiben a termelő neutrofileket opszonizált (előzetesen megjelölt) baktériumokkal aktiváltuk, úgy a keletkezett MV-ok maguk is kimutatható antibakteriális hatással rendelkeztek. Kiemelendő, hogy ezen antibakteriális hatás immár független volt a megtámadott baktérium opszonizációjától, valamint a reaktív gyökök képzésétől is, amely tulajdonságokban élesen eltért a donor neutrofilektől. Mi több, a nem opszonizált baktériumok elleni kapacitásuk minden általunk vizsgált körülmény esetén meghaladta a donor sejtek hasonló kapacitását. További fontos eredmény volt, hogy bizonyítottan Staphylococcus aureus fertőzésben szenvedő betegek vérében a neutrofil eredetű MV-ok száma 5-6-szor haladta meg az egészségesekre jellemző szintet, valamint hogy a betegekből származó MV-ok – vérből való szeparációjukat követően – hasonló viselkedést mutattak, mint a kísérleteinkben bakteriális hatásra keletkezett MV-ok. Ezzel szemben az egészségesekből származó MV-ok a spontán keletkezettekhez mutattak hasonló tulajdonságokat. A hatásmechanizmus hátterében kísérleteink szerint kiemelt szerepe van a baktériumok és MV-ok összetapadásának, vélhetőleg a direkt kapcsolat segítségével képesek a MV-ok gátolni a baktériumok szaporodását.
Összességében tehát egy olyan sejteknél kisebb méretű antibakteriális mechanizmusról van szó, mely független a baktériumok opszonizációjától („megjelöltségétől). E függetlenségnek kiemelt szerepe lehet minden olyan esetben, ahol zavart szenved az opszonizáció (tályogok környezetében, avagy csökkent komplement és/vagy csökkent antitest termeléssel jellemezhető betegségekben), illetve az olyan területek védelmében, ahova csak nehezen jutnak el az immunrendszer sejtjei (pl. ízületi terek). Mindemellett a mechanizmus és az interakció precíz feltárása sokat segíthet egy, az antibiotikumoktól eltérő antibakteriális rendszer megértésében, esetleges modulálásában.
 A kísérleteket 2006 szeptemberében kezdtük. Az eredetileg alig pár mérésesre tervezett vizsgálat végül is hat évig tartott, az Élettani Intézet mellett az Immunológiai Intézet, az Aneszteziológiai és Intenzív Terápiás Klinika, valamint a KOKI munkatársainak részvételével. Rengeteg munkát adott a kísérleti körülmények optimalizálása, és sokszor nehéz volt annak eldöntése is, hogy melyik irányban folytassuk a kutatást, mely metodikát válasszuk. Ebben volt lényeges dr. Buzás Edit, dr. Nagy György, valamint dr. Kittel Ágnes közreműködése. Igen elhúzódóra sikerült a kézirat elfogadtatása is, visszatérő kérdés volt, hogy élőben is megtalálható-e ez a rendszer, amelyet addig kémcsövekben vizsgáltunk. Az Aneszteziológiai és Intenzív Terápiás Klinika munkatársaival való együttműködés lehetővé tette, hogy megfigyeléseinket betegek („ex vivo”) mintáiban is megerősítsük. És végezetül: hálával tartozunk annak a rengeteg egészséges donornak (zömükben orvostanhallgatóknak, munkatársaknak), valamint a betegeknek, akik szó szerint vérüket áldozták, hogy a fenti kutatás elkészülhessen.
A kísérleteket 2006 szeptemberében kezdtük. Az eredetileg alig pár mérésesre tervezett vizsgálat végül is hat évig tartott, az Élettani Intézet mellett az Immunológiai Intézet, az Aneszteziológiai és Intenzív Terápiás Klinika, valamint a KOKI munkatársainak részvételével. Rengeteg munkát adott a kísérleti körülmények optimalizálása, és sokszor nehéz volt annak eldöntése is, hogy melyik irányban folytassuk a kutatást, mely metodikát válasszuk. Ebben volt lényeges dr. Buzás Edit, dr. Nagy György, valamint dr. Kittel Ágnes közreműködése. Igen elhúzódóra sikerült a kézirat elfogadtatása is, visszatérő kérdés volt, hogy élőben is megtalálható-e ez a rendszer, amelyet addig kémcsövekben vizsgáltunk. Az Aneszteziológiai és Intenzív Terápiás Klinika munkatársaival való együttműködés lehetővé tette, hogy megfigyeléseinket betegek („ex vivo”) mintáiban is megerősítsük. És végezetül: hálával tartozunk annak a rengeteg egészséges donornak (zömükben orvostanhallgatóknak, munkatársaknak), valamint a betegeknek, akik szó szerint vérüket áldozták, hogy a fenti kutatás elkészülhessen.
Dr. Timár Csaba, SE Élettani Intézet
Az eredeti közlemény: Antibacterial effect of microvesicles released from human neutrophilic granulocytes (Csaba I. Timár, Ákos M. Lőrincz, Roland Csépányi-Kömi, Anna Vályi-Nagy, György Nagy, Edit I. Buzás, Zsolt Iványi, Ágnes Kittel, David W. Powell , Kenneth R. McLeish, Erzsébet Ligeti)


