A kémiai Nobel-díjat idén három kutatónak ítélték oda: David Baker a fehérjék számítógépes tervezéséért, Demis Hassabis és John M. Jumper pedig a fehérjeszerkezetek előrejelzéséért érdemelte ki az egyik legjelentősebb tudományos elismerést. Baker a Washingtoni Egyetem professzora, aki kutatótársaival szekvencia alapján igyekezett megjósolni a fehérjék térszerkezetét, erre pedig létrehozta a Rosetta nevű szoftvert. Ez széles körben elterjedtté vált, elsősorban fehérjetervezésre használták, ugyanakkor térszerkezet-jóslásra korlátozottan volt alkalmazható. Ezzel szemben Hassabis és Jumper, a Google DeepMind vezető kutatói létrehozták az AlphaFold nevű szoftvert, amely a magas minőségű fehérjeszerkezet előrejelzését megoldotta, ráadásul szabadon is hozzáférhetővé tették, forradalmasítva ezzel a 3D-bioinformatika számos területét és új korszakot elindítva az élettudományok terén – magyarázta dr. Hegedűs Tamás.
A kémiai Nobel-díjat idén három kutatónak ítélték oda: David Baker a fehérjék számítógépes tervezéséért, Demis Hassabis és John M. Jumper pedig a fehérjeszerkezetek előrejelzéséért érdemelte ki az egyik legjelentősebb tudományos elismerést. Baker a Washingtoni Egyetem professzora, aki kutatótársaival szekvencia alapján igyekezett megjósolni a fehérjék térszerkezetét, erre pedig létrehozta a Rosetta nevű szoftvert. Ez széles körben elterjedtté vált, elsősorban fehérjetervezésre használták, ugyanakkor térszerkezet-jóslásra korlátozottan volt alkalmazható. Ezzel szemben Hassabis és Jumper, a Google DeepMind vezető kutatói létrehozták az AlphaFold nevű szoftvert, amely a magas minőségű fehérjeszerkezet előrejelzését megoldotta, ráadásul szabadon is hozzáférhetővé tették, forradalmasítva ezzel a 3D-bioinformatika számos területét és új korszakot elindítva az élettudományok terén – magyarázta dr. Hegedűs Tamás.
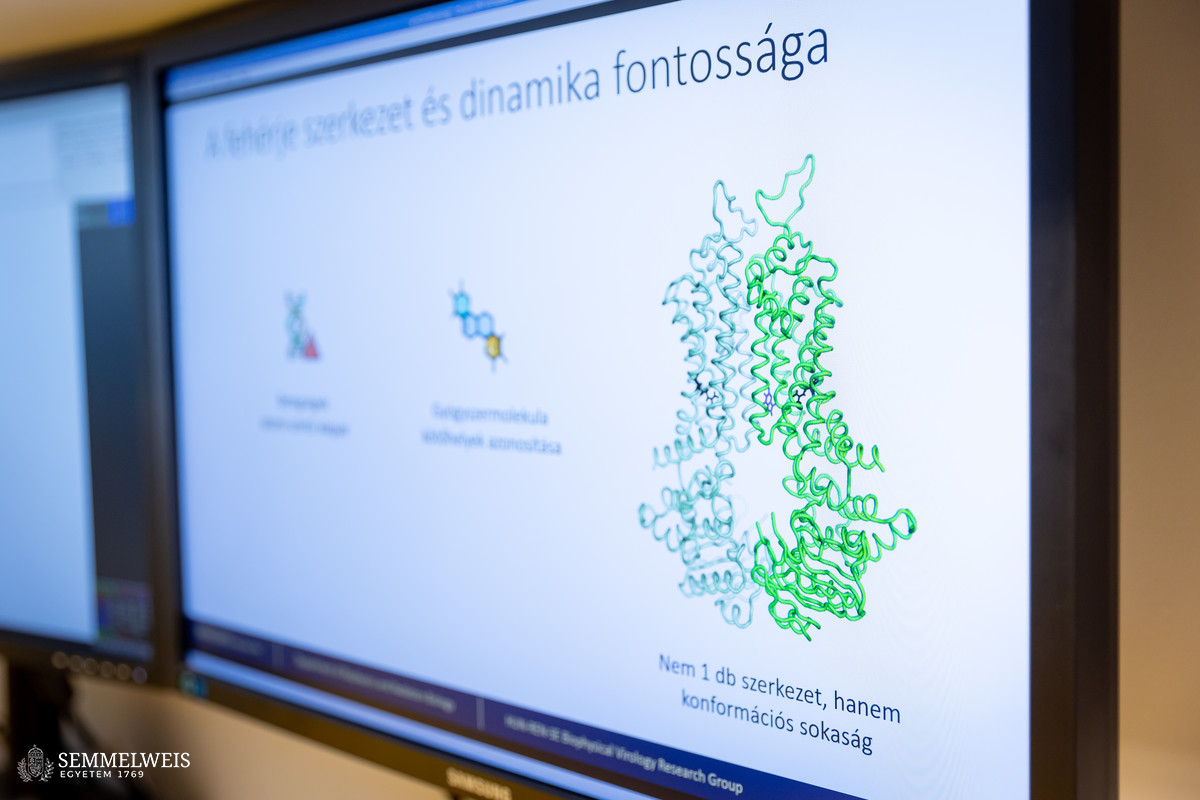
Amint azt a Biofizikai és Sugárbiológiai Intézet kutatóprofesszora elmondta, a fehérjék háromdimenziós szerkezetének feltárása régóta foglalkoztatta a kutatókat. Számos betegség vezethető vissza a fehérjéket kódoló génekben bekövetkező mutációkra. Bár nem minden esetben szükséges az adott fehérje szerkezetének ismerete a gyógyításhoz, a szerkezet pontos megértése kulcsfontosságú lehet bizonyos terápiák vagy gyógyszerfejlesztések során, különösen, ha a mutáció a fehérje működését vagy kölcsönhatásait befolyásolja. „1972-ben Christian Anfinsen amerikai biokémikus Nobel-díjat kapott azért, mert bebizonyította, hogy egy fehérje szekvenciája egyértelműen meghatározza az adott fehérje térszerkezetét is. Egy fehérje szekvenciáját könnyű megismerni, hiszen DNS-t tudunk szekvenálni, abból pedig egyértelműen megtudható a fehérjékben megtalálható aminosavak sorrendje. A fehérje szerkezetének kísérletes meghatározása viszont nagy erőforrásokat igényel, ezért próbálkoznak a kutatók évtizedek óta, hogy elméleti módszerekkel jósolják meg azt” – fejtette ki.
Dr. Hegedűs Tamás szerint az elmúlt 15 év egyik legfontosabb technológiai fejlődése, amely hozzájárult az idén Nobel-díjjal jutalmazott áttöréshez, a grafikus processzorok (GPU-k) drámai fejlődése volt. Ezek az eszközök eredetileg a számítógépes grafika gyorsítására készültek, azonban rendkívüli párhuzamos számítási kapacitásuk révén a tudományos számításokban, például a mesterséges intelligencia és a mély tanulási algoritmusok területén is kulcsszerepet kaptak. A Google DeepMind csapata a GPU-k teljesítményét kihasználva és neurális hálózatokat alkalmazva fejlesztette ki az AlphaFold programot, amely képes a fehérjék térszerkezetét rendkívüli pontossággal előre jelezni.
Dr. Hegedüs Tamás munkatársaival 2022-ben egy magas idézettségű cikket publikált a témában. Ebben azt vizsgálták, hogy vajon az AlphaFold a membránfehérjék szerkezetét is képes-e megfelelő pontossággal megjósolni – ezek szerkezetének predikciója ugyanis különösen nehéz feladat, mert az ilyen fehérjék vizsgálata nemcsak kísérletes, de elméleti módszerekkel is kihívásokkal teli. Pedig a membránfehérjék fontos szerepet játszanak az anyagcserefolyamatokban, a jelátvitelben és a molekuláris transzportban is, a jelenleg elérhető gyógyszerek több mint felének membránfehérje a célpontja – ezért is lenne annyira lényeges megérteni a szerkezetüket. „Észrevettük, hogy az egyik membránfehérje szerkezetének kísérletes meghatározása során hibáztak, így hibásan került be az AlphaFold tanítóhalmazába – a program azonban ennek ellenére is képes volt az adott fehérje térszerkezetét jól megjósolni. Ezzel is bemutattuk, hogy az AlphaFold képes a membránfehérjék szerkezetének predikciójára is” – magyarázta dr. Hegedüs Tamás.
 A Semmelweis Egyetem kutatóprofesszora egy 2022-es publikációt jegyez közösen a DeepMind immár Nobel-díjas kutatóival, Demis Hassabis-szal és John M. Jumperrel. Ez a 3D-Beacon rendszerről, azaz a szerkezeti bioinformatika új standardjáról szól. „Az AlphaFold amellett, hogy képes megjósolni a fehérjék szerkezetét, rendelkezik egy hatalmas adatbázissal is, amely több mint 200 millió fehérje szerkezetét tartalmazza – ezt tették elérhetővé mindenki számára. Emellett a szabadon elérhető AlphaFold szerverrel immár szinte bárki képes szerkezeti modelleket készíteni, ezért ugrásszerűen megnövekedett az ilyen modellek száma” – mutatott rá dr. Hegedűs Tamás. Mint elmondta, ez az adatnövekedés tette szükségessé olyan standardok meghatározását, melyek lehetővé teszik, hogy a fehérjeszerkezeti modellek és azok adatai könnyen megtalálhatók, hozzáférhetőek, eltérő programok által használhatóak és újrafelhasználhatóak legyenek; azaz biztosítják a FAIR (Findable, Accessible, Interoperable, Reusable) alapelveket. Ez a 3D-Beacon rendszer, melynek kidolgozásában dr. Hegedűs Tamás az európai számításos infrastruktúrák összefogásáért felelős Elixir 3D-bioinformatika irányító bizottságának tagjaként vett részt; míg Demis Hassabis és John M. Jumper a Google DeepMind kutatóiként. Dr. Hegedűs Tamás a rendszert ahhoz hasonlítja, mintha a Fővárosi Szabó Ervin Könyvtár katalógusa nemcsak a saját gyűjteményében megtalálható könyveket tartalmazná, hanem minden budapesti lakos olyan könyveit is, amelyek megfelelnek a követelményeknek és tulajdonosa saját példányait regisztrálta a rendszerbe. Mint elmondta, a mai napig tartja a kapcsolatot a DeepMind kutatóival. „Mikor kiderült, hogy Nobel-díjat kaptak, e-mailben gratuláltam nekik. John M. Jumper hosszabban is visszaírt, egy kicsit pedig arról is elbeszélgettünk, mikorra várható az AlphaFold harmadik verziójának teljesen nyílt elérhetősége, ami értékes információnak bizonyult, hiszen kutatóként így előre lehet készülni egy újabb versenyhelyzetre” – húzta alá dr. Hegedűs Tamás.
A Semmelweis Egyetem kutatóprofesszora egy 2022-es publikációt jegyez közösen a DeepMind immár Nobel-díjas kutatóival, Demis Hassabis-szal és John M. Jumperrel. Ez a 3D-Beacon rendszerről, azaz a szerkezeti bioinformatika új standardjáról szól. „Az AlphaFold amellett, hogy képes megjósolni a fehérjék szerkezetét, rendelkezik egy hatalmas adatbázissal is, amely több mint 200 millió fehérje szerkezetét tartalmazza – ezt tették elérhetővé mindenki számára. Emellett a szabadon elérhető AlphaFold szerverrel immár szinte bárki képes szerkezeti modelleket készíteni, ezért ugrásszerűen megnövekedett az ilyen modellek száma” – mutatott rá dr. Hegedűs Tamás. Mint elmondta, ez az adatnövekedés tette szükségessé olyan standardok meghatározását, melyek lehetővé teszik, hogy a fehérjeszerkezeti modellek és azok adatai könnyen megtalálhatók, hozzáférhetőek, eltérő programok által használhatóak és újrafelhasználhatóak legyenek; azaz biztosítják a FAIR (Findable, Accessible, Interoperable, Reusable) alapelveket. Ez a 3D-Beacon rendszer, melynek kidolgozásában dr. Hegedűs Tamás az európai számításos infrastruktúrák összefogásáért felelős Elixir 3D-bioinformatika irányító bizottságának tagjaként vett részt; míg Demis Hassabis és John M. Jumper a Google DeepMind kutatóiként. Dr. Hegedűs Tamás a rendszert ahhoz hasonlítja, mintha a Fővárosi Szabó Ervin Könyvtár katalógusa nemcsak a saját gyűjteményében megtalálható könyveket tartalmazná, hanem minden budapesti lakos olyan könyveit is, amelyek megfelelnek a követelményeknek és tulajdonosa saját példányait regisztrálta a rendszerbe. Mint elmondta, a mai napig tartja a kapcsolatot a DeepMind kutatóival. „Mikor kiderült, hogy Nobel-díjat kaptak, e-mailben gratuláltam nekik. John M. Jumper hosszabban is visszaírt, egy kicsit pedig arról is elbeszélgettünk, mikorra várható az AlphaFold harmadik verziójának teljesen nyílt elérhetősége, ami értékes információnak bizonyult, hiszen kutatóként így előre lehet készülni egy újabb versenyhelyzetre” – húzta alá dr. Hegedűs Tamás.
 Mint elmondta, a 3D-bioinformatika ilyen típusú új megközelítése nemcsak a hatékonyabb és gyorsabb gyógyszerfejlesztéshez járulhat hozzá, hanem a célzottabb készítmények és terápiák megalkotásához is. „Fehérjetervezéssel olyan gyógyszerek is fejleszthetők, melyek speciálisan az adott fehérjéhez, annak specifikus térszerkezetéhez illeszthetők. Sokezer tervezett fehérjét, több millió molekulát próbálhatunk ki, melyik járul hozzá jobban a fehérje szerkezetének helyreállításához, de tesztelhetjük azt is, milyen koncentrációban lehet a leghatékonyabb és kell-e a hatóanyag vízoldékonyságát növelni” – magyarázta. Dr. Hegedűs Tamás szerint a diszciplínában olyan elképesztő ütemű a fejlődés, hogy még a terület szakembereinek is nehéz lépést tartani azzal. „Még 2019-ben, közvetlenül az AlphaFold első verziójának megjelenése előtt is meg voltam győződve arról, hogy úgy megyek majd nyugdíjba, hogy csak az aminosav szekvenciából nem sikerül még jó minőségű szerkezetet jósolni. Ehhez képest három éven belül ez megtörtént” – mutatott rá.
Mint elmondta, a 3D-bioinformatika ilyen típusú új megközelítése nemcsak a hatékonyabb és gyorsabb gyógyszerfejlesztéshez járulhat hozzá, hanem a célzottabb készítmények és terápiák megalkotásához is. „Fehérjetervezéssel olyan gyógyszerek is fejleszthetők, melyek speciálisan az adott fehérjéhez, annak specifikus térszerkezetéhez illeszthetők. Sokezer tervezett fehérjét, több millió molekulát próbálhatunk ki, melyik járul hozzá jobban a fehérje szerkezetének helyreállításához, de tesztelhetjük azt is, milyen koncentrációban lehet a leghatékonyabb és kell-e a hatóanyag vízoldékonyságát növelni” – magyarázta. Dr. Hegedűs Tamás szerint a diszciplínában olyan elképesztő ütemű a fejlődés, hogy még a terület szakembereinek is nehéz lépést tartani azzal. „Még 2019-ben, közvetlenül az AlphaFold első verziójának megjelenése előtt is meg voltam győződve arról, hogy úgy megyek majd nyugdíjba, hogy csak az aminosav szekvenciából nem sikerül még jó minőségű szerkezetet jósolni. Ehhez képest három éven belül ez megtörtént” – mutatott rá.
 „A biológia és kémiai mellett mindig is érdeklődtem a matematika és a geometria iránt, amelyben piarista tanáraim kulcsszerepet játszottak. Gimnazista voltam, amikor felfedezték a szén új elemi módosulatait, a fulleréneket, amelyek különösen felkeltették kíváncsiságomat. Úgy néznek ki, mint egy focilabda, aminek csúcsain szénatomok találhatók – én pedig megpróbáltam megérteni, hogyan lehetne tetszőleges számú szénatomból ilyen zárt térszerkezeteket fölépíteni” – emlékezett vissza, mikor kezdődött tudományos érdeklődése a térszerkezetek iránt. 1998-ban biológia-kémia szakon szerzett diplomát az Eötvös Loránd Tudományegyetemen (ELTE). 1994 és 2003 között Sarkadi Balázs laboratóriumában folytatott tudományos kutatómunkát, melynek középpontjában az ABC-transzporterek, az egyik legnagyobb és legősibb fehérje szupercsalád tagjai álltak. Szintén Sarkadi Balázs vezetésével, az ELTE Doktori Iskolájában szerzett PhD-fokozatot molekuláris sejtbiológiából. Ezt követően posztdoktori kutatóként az egyesült államokbeli Mayo Klinikán kutatott, majd az ottani laboratórium átköltözése után az Észak-Karolinai Egyetem (UNC) Chapel Hill-i kampuszán, a Cisztás Fibrózis Központban dolgozott tovább 2009-ig. „A szomszéd laborban dolgozott egy elméleti csoport, elkezdtünk tanulni egymástól, átjárni egymás munkabeszámolóira – így tanultam meg a szerkezeti bioinformatika alapjait” – emlékezett vissza. 2009-ben tért haza Magyarországra, ahol az MTA-SE Membránbiológiai Kutatócsoporthoz (Támogatott Kutatócsoportok Irodája) csatlakozott tudományos főmunkatársként. 2017 óta a Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézetének munkatársa, 2022 óra az ELKH-SE Biofizikai Virológiai Kutatócsoportjának is tagja.
„A biológia és kémiai mellett mindig is érdeklődtem a matematika és a geometria iránt, amelyben piarista tanáraim kulcsszerepet játszottak. Gimnazista voltam, amikor felfedezték a szén új elemi módosulatait, a fulleréneket, amelyek különösen felkeltették kíváncsiságomat. Úgy néznek ki, mint egy focilabda, aminek csúcsain szénatomok találhatók – én pedig megpróbáltam megérteni, hogyan lehetne tetszőleges számú szénatomból ilyen zárt térszerkezeteket fölépíteni” – emlékezett vissza, mikor kezdődött tudományos érdeklődése a térszerkezetek iránt. 1998-ban biológia-kémia szakon szerzett diplomát az Eötvös Loránd Tudományegyetemen (ELTE). 1994 és 2003 között Sarkadi Balázs laboratóriumában folytatott tudományos kutatómunkát, melynek középpontjában az ABC-transzporterek, az egyik legnagyobb és legősibb fehérje szupercsalád tagjai álltak. Szintén Sarkadi Balázs vezetésével, az ELTE Doktori Iskolájában szerzett PhD-fokozatot molekuláris sejtbiológiából. Ezt követően posztdoktori kutatóként az egyesült államokbeli Mayo Klinikán kutatott, majd az ottani laboratórium átköltözése után az Észak-Karolinai Egyetem (UNC) Chapel Hill-i kampuszán, a Cisztás Fibrózis Központban dolgozott tovább 2009-ig. „A szomszéd laborban dolgozott egy elméleti csoport, elkezdtünk tanulni egymástól, átjárni egymás munkabeszámolóira – így tanultam meg a szerkezeti bioinformatika alapjait” – emlékezett vissza. 2009-ben tért haza Magyarországra, ahol az MTA-SE Membránbiológiai Kutatócsoporthoz (Támogatott Kutatócsoportok Irodája) csatlakozott tudományos főmunkatársként. 2017 óta a Semmelweis Egyetem Biofizikai és Sugárbiológiai Intézetének munkatársa, 2022 óra az ELKH-SE Biofizikai Virológiai Kutatócsoportjának is tagja.
2024-ben a „Mesterséges intelligencia alapú minifehérje-tervezés az immunoszuppresszió célzására rákban” című projektje elnyerte a HU-RIZONT Nemzetközi Kiválósági Kutatási Együttműködési Program támogatását. Egy olyan transzmembrán fehérje kutatásával foglalkozik, amely az immunválasz gátlásában játszik szerepet. Ez a fehérje kulcsszerepet tölthet be azoknak a rákos megbetegedéseknek a kezelésében, ahol túlműködése hozzájárul a betegség progressziójához.
Szabó Ádám
Fotó: Zellei Boglárka – Semmelweis Egyetem
A cikket a Semmelweis Egyetem Kommunikációs Igazgatósága tette közzé.