Szövetsérülés esetén a szervezet perceken belül mozgósítja a védekező mechanizmusait a külvilág potenciális kórokozóival szemben. A Nobel-díjas Ilja Iljics Mecsnikov tengericsillag lárvák mikroszkópos vizsgálata közben vette észre, hogy sérülésüket követően sejtek vándorolnak a sebzés irányába – így fedezte fel a ma fagocitáknak nevezett immunsejteket. Bár az alapjelenség közel 150 éve ismert, e finoman szabályozott folyamat számos részletét a mai napig nem értjük pontosan. Zebrahalakon végzett kísérleteinkben sebet ejtünk a 2-3 milliméteres zebrahal lárvák farokúszóján, és mikroszkóppal láthatóvá tesszük azokat a szabályozó folyamatokat, melyek lehetővé teszik, hogy percek alatt fehérvérsejtek vándoroljanak a sérülés területére, hogy megvédjék a szervezetet a patogénektől és elősegítsék a seb összehúzódását, illetve későbbi gyógyulását – magyarázta dr. Enyedi Balázs.
A biológiai folyamatok megértéséhez a kutatók évszázadok óta használnak különböző modellrendszereket. A zebrahalakat egy magyar származású amerikai molekuláris biológus, Streisinger György honosította meg a kutatás világában a 60-as években. A zebrahalakat kezdetben főképp fejlődésbiológiai vizsgálatokra használták, mivel külső megtermékenyítéssel szaporodnak, így akár fénymikroszkóp alatt is könnyen megfigyelhető, ahogy egysejtes stádiumból kifejlődik az állat. Humán betegségek modellezésére a 2000-es évek során kezdték használni, eleinte főképp monogénes genetikai betegségek vizsgálatára, majd egyre szélesebb körben, többek között gyulladás- és tumorbiológiai kérdések megválaszolására. Dr. Enyedi Balázs munkacsoportja azért választotta a zebrahalakat saját kutatásaihoz, mivel a sejtszintű gyulladásos folyamatok hasonló módon játszódnak le bennük, mint az emlős, illetve humán rendszerekben. Kihasználják, hogy lárváik átlátszóak, így különösen jól vizsgálhatók mikroszkóp alatt. Emellett a zebrahalak genetikailag módosíthatók, így a laborban olyan transzgéneket, úgynevezett fluoreszcens szenzorokat tudnak beépíteni a halak genetikai állományába, melyek lehetővé teszik, hogy mikroszkóp alatt élő lárvákban kövessék nyomon az általuk vizsgálni kívánt molekulákat.
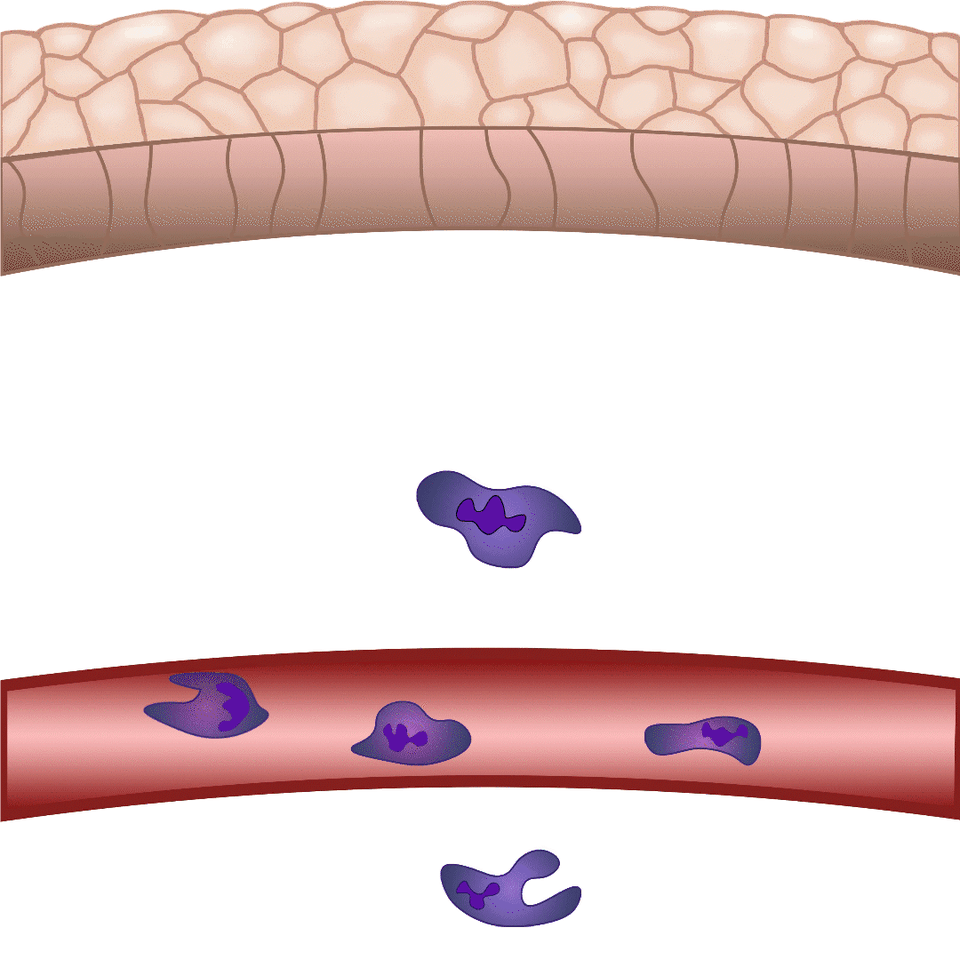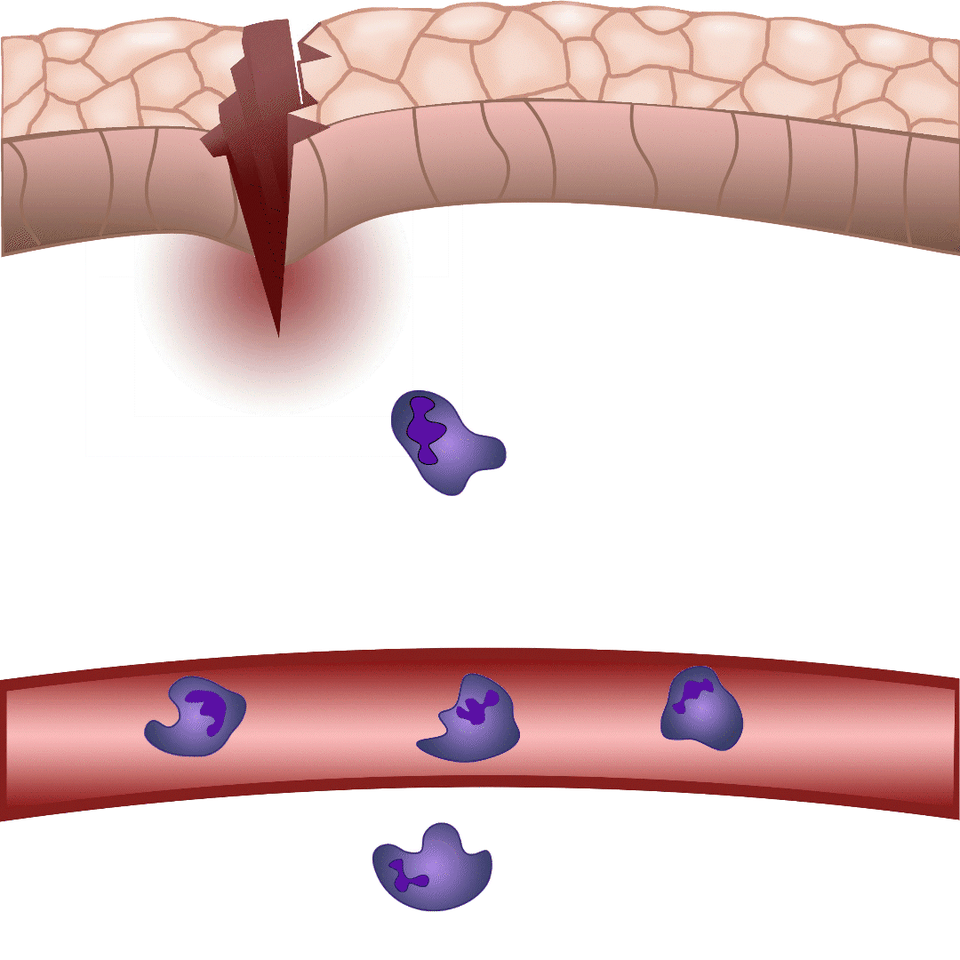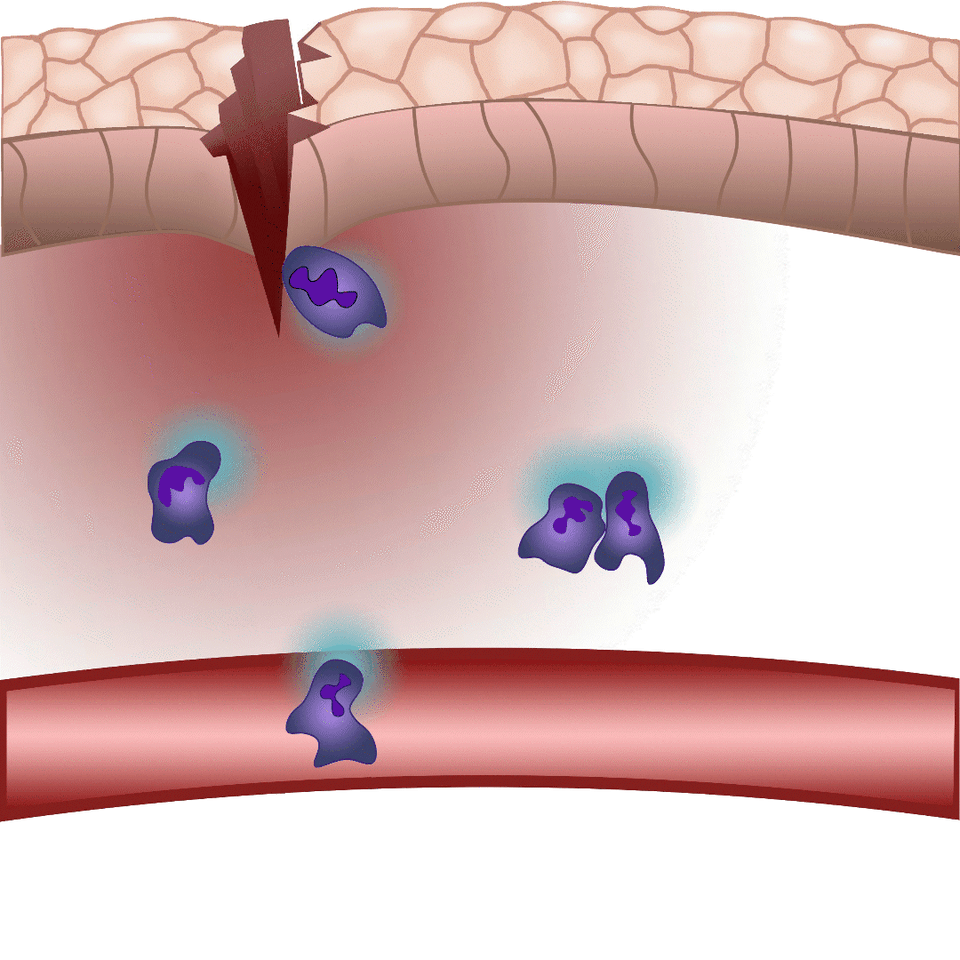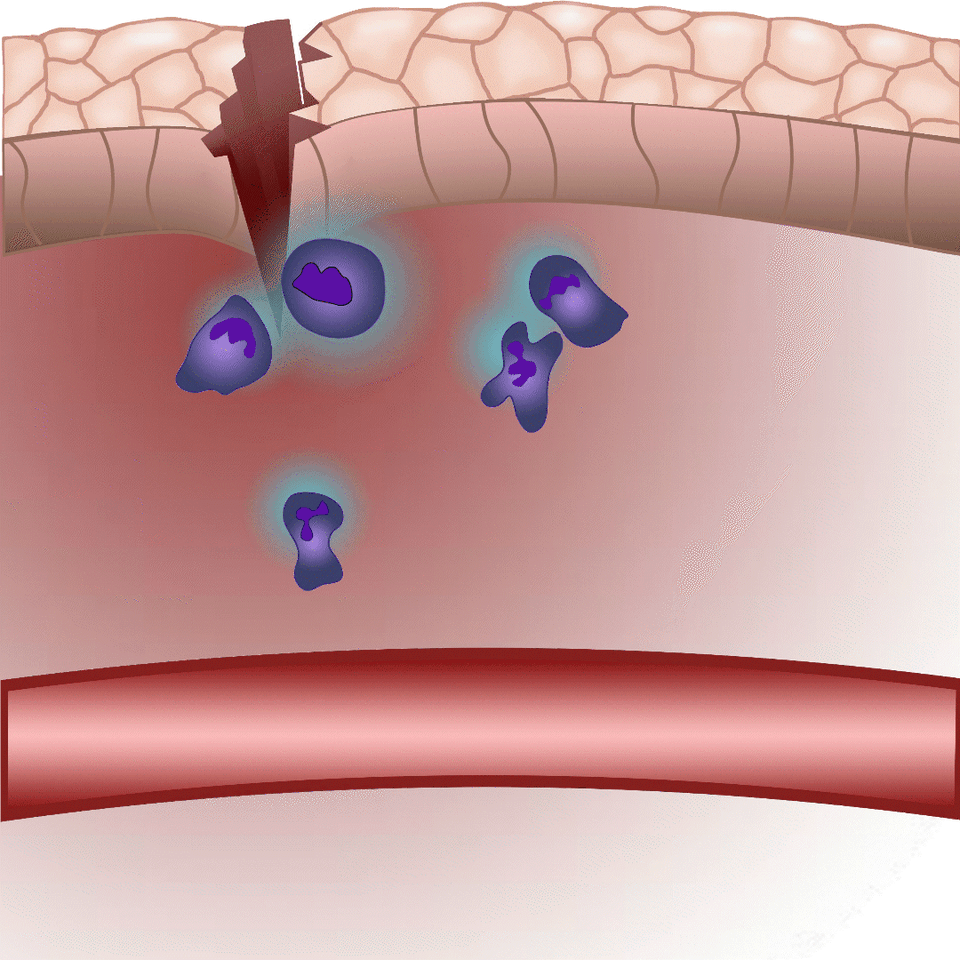
 A környezeti kémiai ingerek hatására beinduló sejtmozgást kemotaxisnak nevezünk, kemoattraktánsnak pedig azokat a molekulákat, melyek fokozzák a sejtvándorlást az adott kémiai inger irányába. Sebzést követően olyan kemoattraktánsok termelődnek, illetve szabadulnak fel a sérült szövetben, melyek fehérvérsejtek migrációját és helyi gyulladást váltanak ki. Ezen molekulákat azonban valós időben eddig nem lehetett megfigyelni, nem tudtuk, hogy pontosan mikor és milyen sejtekből szabadulnak fel, nem ismertük, hogy milyen távolságra jutnak el a forrástól – fogalmazott az egyetemi docens. Új módszerük lényege, hogy a gyulladást szabályozó molekulák közül egyet, a leukotrién B4-et valós időben tették láthatóvá, illetve mérhetővé. Így gyulladással járó folyamatok során először vált vizsgálhatóvá egy kemoattraktáns felszabadulásának helye, illetve szöveti eloszlása.
A környezeti kémiai ingerek hatására beinduló sejtmozgást kemotaxisnak nevezünk, kemoattraktánsnak pedig azokat a molekulákat, melyek fokozzák a sejtvándorlást az adott kémiai inger irányába. Sebzést követően olyan kemoattraktánsok termelődnek, illetve szabadulnak fel a sérült szövetben, melyek fehérvérsejtek migrációját és helyi gyulladást váltanak ki. Ezen molekulákat azonban valós időben eddig nem lehetett megfigyelni, nem tudtuk, hogy pontosan mikor és milyen sejtekből szabadulnak fel, nem ismertük, hogy milyen távolságra jutnak el a forrástól – fogalmazott az egyetemi docens. Új módszerük lényege, hogy a gyulladást szabályozó molekulák közül egyet, a leukotrién B4-et valós időben tették láthatóvá, illetve mérhetővé. Így gyulladással járó folyamatok során először vált vizsgálhatóvá egy kemoattraktáns felszabadulásának helye, illetve szöveti eloszlása.
Gyakorlatilag egy új szemüveget fejlesztettünk, amellyel láthatóvá tettünk egy központi jelentőségű gyulladásszabályozó molekulát
– mutatott rá dr. Enyedi Balázs.
Sérüléskor a szövetek „gyulladásos koktélt” termelnek – ennek hatására indul be az a reakció, melynek részeként fehérvérsejtek áramlanak az érintett területre. Minél nagyobb a sérülés, illetve minél több patogén jut a külvilágból a szervezetbe, annál több fehérvérsejtet kell a területre irányítani. A leukotrién B4 egy arachidonsavból termelődő központi gyulladásos mediátor, mely nagyon erős kemoattraktánsként fehérvérsejtek „rajzását” váltja ki. Maguk a fehérvérsejtek termelik gyulladásos környezetben, de a mai napig nem értjük pontosan a leukotrién B4 felszabadulás szabályozását. Erre is választ adhat többek között a jövőben az általunk kidolgozott módszer – hívta fel a figyelmet dr. Enyedi Balázs.
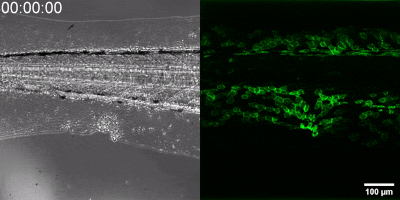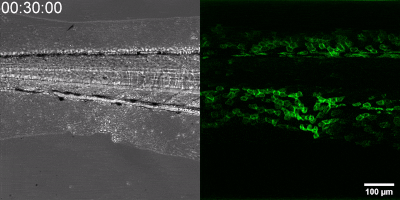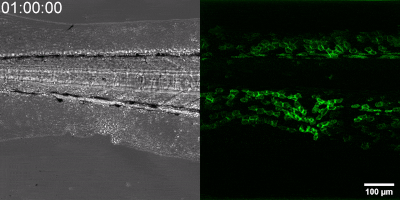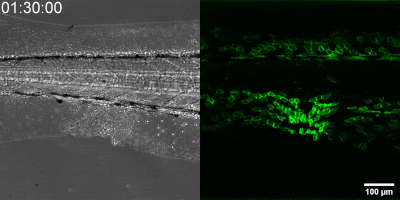 Az általuk kidolgozott új módszer lényege, hogy a leukotrién B4 receptorából kiindulva, annak szekezetét módosítva bioszenzort hoztak létre. A szenzor zöld fluoreszcenciája leukotrién B4 hatására jelentősen megnő, így fluoreszcens mikroszkóp alatt mérhető, sőt látható, ahogy a zöld fény intenzitása változik a leukotrién B4 koncentráció függvényében (amint az az illusztráción is látható). A bioszenzort kódoló DNS-szakasz bejuttatható a kísérletek során vizsgált sejtekbe, melyek így maguk hozzák létre a szenzort. Ezen a módon transzgenikus zebrahalak vagy akár egerek is létrehozhatók, melyekben meghatározott sejtek kifejezik szenzort, így lehetővé teszik a saját környezetükben a leukotrién B4 mikroszkópos kimutatását. Kis méretű molekulaként a leukotrién B4 percek alatt eldiffundál a forrástól, így klasszikus immunfestési eljárásokkal nem vizsgálható fixált szövetekben. Az új módszerrel azonban valós időben követhető zöld fluoreszcens szignálként transzgenikus állatokban a leukotrién B4 felszabadulása – húzta alá dr. Enyedi Balázs.
Az általuk kidolgozott új módszer lényege, hogy a leukotrién B4 receptorából kiindulva, annak szekezetét módosítva bioszenzort hoztak létre. A szenzor zöld fluoreszcenciája leukotrién B4 hatására jelentősen megnő, így fluoreszcens mikroszkóp alatt mérhető, sőt látható, ahogy a zöld fény intenzitása változik a leukotrién B4 koncentráció függvényében (amint az az illusztráción is látható). A bioszenzort kódoló DNS-szakasz bejuttatható a kísérletek során vizsgált sejtekbe, melyek így maguk hozzák létre a szenzort. Ezen a módon transzgenikus zebrahalak vagy akár egerek is létrehozhatók, melyekben meghatározott sejtek kifejezik szenzort, így lehetővé teszik a saját környezetükben a leukotrién B4 mikroszkópos kimutatását. Kis méretű molekulaként a leukotrién B4 percek alatt eldiffundál a forrástól, így klasszikus immunfestési eljárásokkal nem vizsgálható fixált szövetekben. Az új módszerrel azonban valós időben követhető zöld fluoreszcens szignálként transzgenikus állatokban a leukotrién B4 felszabadulása – húzta alá dr. Enyedi Balázs.
Eddigi vizsgálatukban a leukotrién B4-re fejlesztettek bioszenzort, de kutatásuk általánosítható és egyéb, a gyulladásos folyamatokat szabályozó további molekulák kimutatására is alkalmas szenzorokat fejleszthetnek a módszerrel.
 „A kutatásnak több jövőbe mutató aspektusa is van. Általa jobban megérthetővé válik a gyulladás biológiája és patológiája: rengeteg kutatócsoport foglalkozik ezzel, akiknek évtizedes álma, hogy ne csak elvi szinten értsük a molekulák felszabadulását és diffundálását, de láthassuk is ezt a folyamatot. A módszerünkkel jobb képet kaphatunk a gyulladásbiológiát szabályozó faktorok pontos szerepéről akár különböző betegségmodellekben is – ez a kulcs ahhoz, hogy a jövőben hatékonyabb terápiás eszközöket lehessen fejleszteni. Másrészt az eddig létrehozott és most fejlesztés alatt álló új kemoattraktáns bioszenzorok lehetőséget adnak arra is, hogy az eddigi módszereknél gyorsabban és hatékonyabban találjunk a kemoattraktánsok működését befolyásoló molekulákat, gátlószereket. Jelenleg főképp a gyulladást szabályozó molekulák biológiai hatásának jobb megértése a célunk, de hosszabb távú terveink között szerepel az is, hogy fejlesztéseink révén gátlószerek azonosításával bekapcsolódjunk a gyógyszeripari kutatásokba” – emelte ki dr. Enyedi Balázs.
„A kutatásnak több jövőbe mutató aspektusa is van. Általa jobban megérthetővé válik a gyulladás biológiája és patológiája: rengeteg kutatócsoport foglalkozik ezzel, akiknek évtizedes álma, hogy ne csak elvi szinten értsük a molekulák felszabadulását és diffundálását, de láthassuk is ezt a folyamatot. A módszerünkkel jobb képet kaphatunk a gyulladásbiológiát szabályozó faktorok pontos szerepéről akár különböző betegségmodellekben is – ez a kulcs ahhoz, hogy a jövőben hatékonyabb terápiás eszközöket lehessen fejleszteni. Másrészt az eddig létrehozott és most fejlesztés alatt álló új kemoattraktáns bioszenzorok lehetőséget adnak arra is, hogy az eddigi módszereknél gyorsabban és hatékonyabban találjunk a kemoattraktánsok működését befolyásoló molekulákat, gátlószereket. Jelenleg főképp a gyulladást szabályozó molekulák biológiai hatásának jobb megértése a célunk, de hosszabb távú terveink között szerepel az is, hogy fejlesztéseink révén gátlószerek azonosításával bekapcsolódjunk a gyógyszeripari kutatásokba” – emelte ki dr. Enyedi Balázs.
A kutató 2006-ban szerzett diplomát a Semmelweis Egyetem Általános Orvosi Karán, majd PhD-munkáját az Élettani Intézetben végezte dr. Geiszt Miklós, az intézet egyetemi tanárának kutatócsoportjában, amely reaktív oxigén származékokkal foglalkozott. Dr. Enyedi Balázs már itt is fluoreszcens szenzorokat fejlesztett, amellyel az egyik reaktív oxigén származék, a hidrogén peroxid szintjét mérte a sejtekben. Ezt követően felvételt nyert az Egyesült Államokban a New York-i Memorial Sloan Kettering Cancer Center központjában található sejtbiológiai intézetbe. Itt ismerkedett meg többek között a zebrahal modellrendszerrel is.
Egy fiatal munkacsoportvezető, dr. Philipp Niethammer laborjába kerültem, ami karrierem szempontjából különösen szerencsés volt: posztdoktorként szemtanúja lehettem egy labor felépítésének, ezt a tudást pedig később magam is kamatoztathattam. 2011-2016 között dolgoztam az Egyesült Államokban, ahol megismerkedtem a zebrahal modellrendszerrel, majd visszatértem a Semmelweis Egyetemre, ahol nekiláttam a zebrahal-kutatás, illetve az ehhez kapcsolódó élő mikroszkópia infrastruktúráját kiépíteni, melyek addig nem voltak jelen az intézményben
– mutatott rá. Mindehhez nemcsak a Semmelweis Egyetemtől kapott támogatást: 2018-ban elnyerte a Magyar Tudományos Akadémia Lendület-programjának pályázatát – ennek, az egyetemi startup-programnak, valamint az Innovációs Igazgatóság támogató programjainak a segítségével indulhatott el kutatócsoportja az Élettani Intézet keretein belül. „Míg Amerikában egy jól karbantartott, kész rendszerrel dolgozhattam, itthon nulláról kellett kezdeni a munkát: az állatház aprólékos építészeti átalakításától kezdve a világítási rendszer kidolgozásán át egészen a zebrahalak életterének kialakításáig mindent a csapatommal együtt kellett kitalálnunk” – magyarázta, hozzátéve: még amerikai kutatói éveiben publikált egy-egy tanulmányt a legrangosabb folyóiratok közé tartozó Nature Cell Biology-ban, valamint a Cell-ben, ezzel érdemelte ki a bizalmat arra, hogy Magyarországon is folytathassa kutatásait. Fiatal munkacsoportvezetőként bekerült a Magyar Molekuláris Medicina Kiválósági Központ (HCEMM) támogatottjai közé is, melynek tagjaként a Heidelbergben található Európai Molekuláris Biológiai Laboratóriummal is szoros kapcsolatban dolgozhat.
 A kutatócsoport eredményeiről beszámoló publikáció a rangos, 15-20 közötti impakt faktorral rendelkező Nature Communications-ben jelent meg. A publikációt ugyan a folyóirat gyorsan jóváhagyta, az azonban hosszú évek munkája volt, míg idáig eljutottak. „A kiépült mikroszkópos rendszernél, a műszereknél és a zebrahal-modelleknél is fontosabb az a csapat, akikkel együtt dolgozom. Jelenleg tízen vagyunk: rajtam kívül három PhD- és két MD-PhD-hallgató, két posztdoktor kutató, és két labor- illetve állatházi menedzser tagja a kutatócsoportnak, közöttük akad francia és német kutató is. Nemcsak lelkes és fiatal tehát a csapat, de nemzetközi is” – mutatott rá dr. Enyedi Balázs, hozzátéve: a munkájukat több TDK-s hallgató is segíti, akikkel külön öröm számára foglalkozni.
A kutatócsoport eredményeiről beszámoló publikáció a rangos, 15-20 közötti impakt faktorral rendelkező Nature Communications-ben jelent meg. A publikációt ugyan a folyóirat gyorsan jóváhagyta, az azonban hosszú évek munkája volt, míg idáig eljutottak. „A kiépült mikroszkópos rendszernél, a műszereknél és a zebrahal-modelleknél is fontosabb az a csapat, akikkel együtt dolgozom. Jelenleg tízen vagyunk: rajtam kívül három PhD- és két MD-PhD-hallgató, két posztdoktor kutató, és két labor- illetve állatházi menedzser tagja a kutatócsoportnak, közöttük akad francia és német kutató is. Nemcsak lelkes és fiatal tehát a csapat, de nemzetközi is” – mutatott rá dr. Enyedi Balázs, hozzátéve: a munkájukat több TDK-s hallgató is segíti, akikkel külön öröm számára foglalkozni.
A publikációig vezető út során az egyik legemlékezetesebb pillanatnak azt tartja, amikor egy évekkel ezelőtti karácsony előtt néhány nappal először látta, hogy működik a leukotrién B4 szenzoruk prototípusa. Ezt követően közel három évet kellett dolgozniuk azon, hogy sikeresen tudják mérni zebrahal állatmodellben a leukotrién B4 felszabadulását fehérvérsejtekből. A legnagyobb nehézség is épp ebből fakadt: irodalmi adatok alapján hosszú hónapokig más időablakban számítottak a kísérletek során a leukotrién B4 felszabadulására, így sokáig azt hitték gond van a rendszerrel, mivel túl rövid ideig végezték a méréseket.
Mint dr. Enyedi Balázs elmondta, eredményeikhez rengetegen gratuláltak itthon és külföldön is. A Nature Communications-ben megjelent publikáció előtt már bemutatta kutatását több konferencián, mely már ekkor nagy feltűnést keltett és többen is érdeklődtek iránta – ez az érdeklődés a rangos helyen megjelenő közleménynek köszönhetően tovább nőtt. „Az eszközt sokan használhatják saját kísérleteikben, több megkeresés is érkezett Amerikától kezdve Németországon át Angliáig” – húzta alá. Dr. Enyedi Balázs hozzátette: a publikáció csak a kezdetet jelenti kutatócsoportja számára, amely kijelöli azt az utat, amelyen a következő 5-10 évben haladni szeretnének.
Szabó Ádám
Fotó: Kovács Attila – Semmelweis Egyetem
A cikket a Semmelweis Egyetem Kommunikációs Igazgatósága tette közzé.