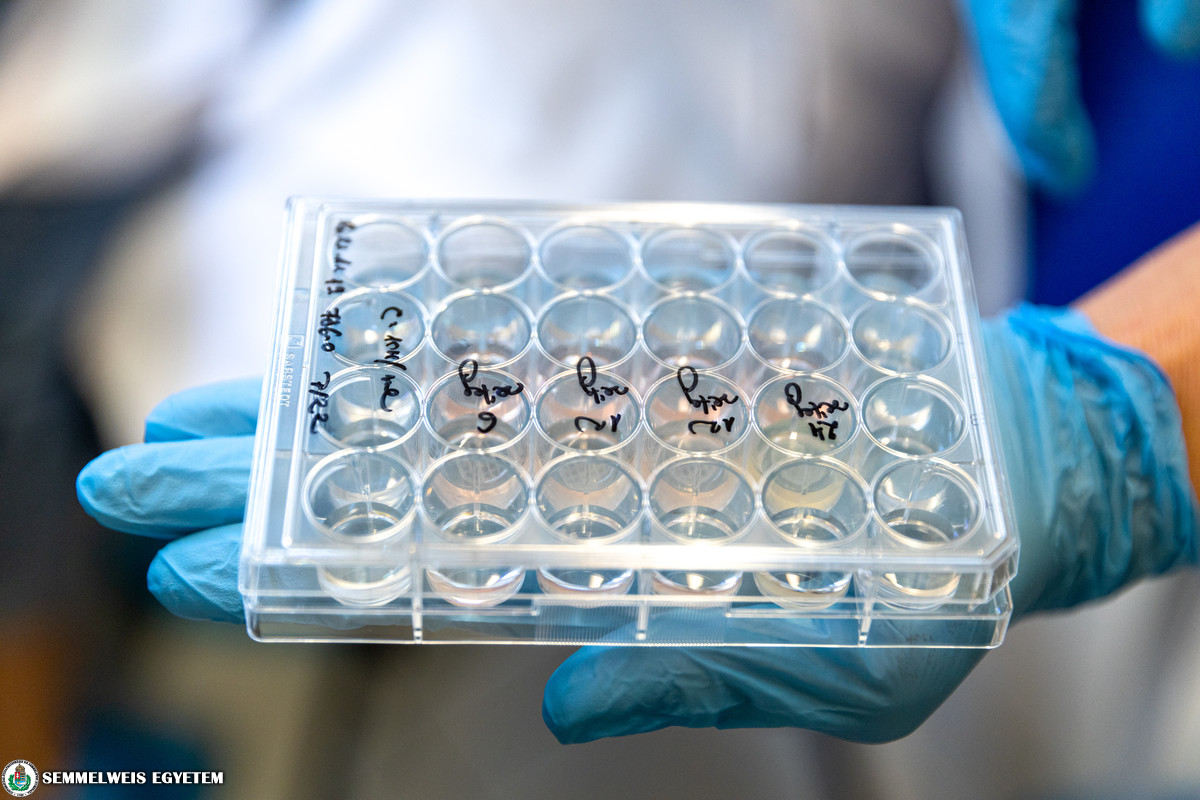
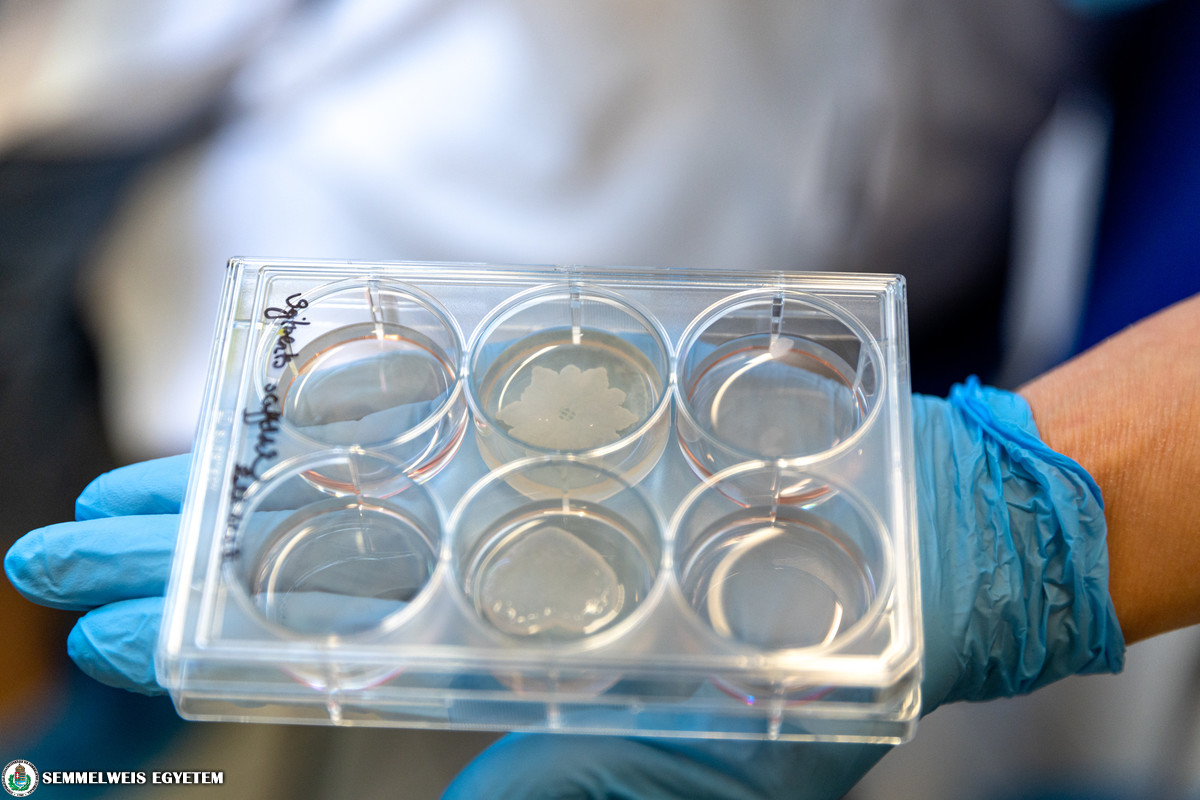
Az I. Sz. Patológiai és Kísérleti Rákkutató Intézet Tumorbiológiai laboratóriuma a daganatok anyagcsere változásaival és ezek terápiás célú gátlásával foglalkozik. Az intézetbe érkező tumormintákból enzimek segítségével tumoros és egyéb sejtek izolálhatók, majd ezeket gélszerű mátrixanyagba keverve biotinta készíthető a 3D nyomtatáshoz. A számítógépvezérelt speciális készülék egyszerre többféle biotintával képes összetett, szövetszerű struktúrákat nyomtatni. A mikrométer pontosságú bionyomtatást sűrített levegő nyomása segíti. A sejtek közötti mátrixanyag keresztkötésével stabilizálható a nyomtatott struktúra, így biztosítható az előre megtervezett forma megtartása (pl. érszerű hálózatok, kis szövetkorong, különböző sejtrétegek stb.). A kinyomtatott struktúrához tápfolyadékot adnak, majd néhány napig, esetleg pár hétig tartó tenyésztés után létrejönnek a valódi szövetekhez hasonló, sejt-sejt kapcsolatokat kialakító modellek. Általában egy kis darab tumorszövetből nagy mennyiségű tumor- és egyéb sejt izolálható, így a különböző sejteket tartalmazó biotintákból sok kisméretű, tetszőleges alakú, in vitro növekedni képes szövetmodell nyomtatható. Ezeket a legkülönbözőbb vizsgálatokban, például potenciális daganatellenes hatóanyagok vagy modern molekuláris diagnosztikai eljárások után felmerülő célzott kezelések tesztelésében is fel lehet használni. Az így kapott eredmények nemcsak az alapkutatási projekteket, de a személyre szabott kezelések minél precízebb megtervezését is segíthetik a jövőben. A nyomtatási eljárás segítségével kialakítható tesztek lehetővé tennék a diagnózissal egyidőben felállítható, egyénre szabott, az adott tumor esetében szelektált hatóanyagokat tartalmazó terápiás terv kialakítását. Az alkalmazás bevezetéséhez pontos protokollok kidolgozása szükséges, amihez jelenleg állati tumorszövet mintákkal folynak a vizsgálatok. Ezt követően kezdődhet meg a technológia tesztelése műtéti tumorok esetében.
Az I. Sz. Patológiai és Kísérleti Rákkutató Intézet Tumorbiológiai laboratóriuma a daganatok anyagcsere változásaival és ezek terápiás célú gátlásával foglalkozik. Az intézetbe érkező tumormintákból enzimek segítségével tumoros és egyéb sejtek izolálhatók, majd ezeket gélszerű mátrixanyagba keverve biotinta készíthető a 3D nyomtatáshoz. A számítógépvezérelt speciális készülék egyszerre többféle biotintával képes összetett, szövetszerű struktúrákat nyomtatni. A mikrométer pontosságú bionyomtatást sűrített levegő nyomása segíti. A sejtek közötti mátrixanyag keresztkötésével stabilizálható a nyomtatott struktúra, így biztosítható az előre megtervezett forma megtartása (pl. érszerű hálózatok, kis szövetkorong, különböző sejtrétegek stb.). A kinyomtatott struktúrához tápfolyadékot adnak, majd néhány napig, esetleg pár hétig tartó tenyésztés után létrejönnek a valódi szövetekhez hasonló, sejt-sejt kapcsolatokat kialakító modellek. Általában egy kis darab tumorszövetből nagy mennyiségű tumor- és egyéb sejt izolálható, így a különböző sejteket tartalmazó biotintákból sok kisméretű, tetszőleges alakú, in vitro növekedni képes szövetmodell nyomtatható. Ezeket a legkülönbözőbb vizsgálatokban, például potenciális daganatellenes hatóanyagok vagy modern molekuláris diagnosztikai eljárások után felmerülő célzott kezelések tesztelésében is fel lehet használni. Az így kapott eredmények nemcsak az alapkutatási projekteket, de a személyre szabott kezelések minél precízebb megtervezését is segíthetik a jövőben. A nyomtatási eljárás segítségével kialakítható tesztek lehetővé tennék a diagnózissal egyidőben felállítható, egyénre szabott, az adott tumor esetében szelektált hatóanyagokat tartalmazó terápiás terv kialakítását. Az alkalmazás bevezetéséhez pontos protokollok kidolgozása szükséges, amihez jelenleg állati tumorszövet mintákkal folynak a vizsgálatok. Ezt követően kezdődhet meg a technológia tesztelése műtéti tumorok esetében.
Az intézet sejtbankjában több mint 200 féle humán tumorsejtvonal is elérhető. Ezek közül a népegészségügyi szempontból legjelentősebb daganatsejtekkel megkezdtük vizsgálatainkat; nyomtatunk 3D-s szövetszerű struktúrát emlő- és tüdődaganatsejtekből, illetve teszteljük a nyomtatást vastagbélrák- és vesedaganatsejtekkel is
– magyarázta dr. Sebestyén Anna, az I. Sz. Patológiai és Kísérleti Rákkutató Intézet tudományos főmunkatársa, a Sejt- és Szövettenyésztő Labor vezetője.
Online Core Facility rendszer a Semmelweis Egyetemen
Az élősejtes 3D bionyomtató struktúra már elérhető a Semmelweis Egyetem online Core Facility rendszerében is. Ebbe azok az eszközök és szolgáltatások kerülnek be, amelyek nemcsak az egyetemi kutatók számára, de szolgáltatási díj ellenében vagy kollaborációs alapon külső kutatóknak is elérhetőek ipari vagy akadémiai felhasználás céljából.
Cikksorozatunkban a Semmelweis Egyetem Core Facility rendszerébe bekerülő új kutatási infrastruktúrákat mutatjuk be. A Core Facilily honlapja jelenleg belső egyetemi hálózatról érhető el. Amint a szolgáltatások külső partnerek számára is elérhetővé válnak, a nyitott online felületről is kereshető lesz ez a menüpont.
A 3D bionyomtató labor működtetéséhez professzionális sejt- és szövettenyésztő laborra, valamint állatházra is szükség van – emelte ki a kutató, hozzátéve, hogy az I. Sz. Patológiai és Kísérleti Rákkutató Intézetben ezek rendelkezésükre állnak. Az így felállt unikális kutatási infrastruktúra ipari együttműködések és külső-belső akadémiai kollaborációk kiszolgálására is készen áll.
A daganatkutatás mellett a 3D bionyomtató számtalan egyéb projektben is felhasználható: a gyógyszer-, élelmiszer- és kozmetika ipar például úgynevezett organ- vagy body-on-chip modellek segítségével az állatkísérleteket kiváltva toxicitási teszteket hajthat végre vele. Ezeknek a modelleknek a lényege, hogy kis lemezekre 3D bionyomtatóval különböző típusú élő szöveteket nyomtatnak, melyeknek a folyadék-, tápanyag- és oxigénutánpótlását, valamint fenntartását úgy biztosítják, hogy különböző, az ereket is modellező hálózatokkal kötik össze; a toxicitási vizsgálatokat pedig az így kapott modellekben végzik el.
A 3D bionyomtató új távlatokat nyithat a kutatásokban. „A daganatkutatással kapcsolatos vizsgálatokban jellemzően állatkísérleteket, vagy sejtes modelleket, úgynevezett sejtvonalakat használunk. Utóbbiak emberi tumorokból izolált, in vitro fenntartható sejtek, melyek általában a tenyésztőedények aljához tapadnak és így kétdimenziós sejtkultúrákban növekednek. Egyre jobban ismert azonban a sejtek eltérő viselkedése két- és háromdimenziós környezetben, ahol nemcsak a sejtek növekedése, de egyéb fontos jellegzetességeik is megváltoznak. Az élő szervezetben, a daganatszövetben a tumorsejtek mellett más sejtek (pl. immunsejtek, erek, kötőszöveti sejtek) és sejtközötti egyéb anyagok is jelen vannak. Fontosak a kialakuló oxigén- és tápanyagellátási különbségek is, amelyet kétdimenziós sejtkultúrákban szintén nehéz létrehozni. Ezt a komplexitást és a fiziológiás viszonyokat a háromdimenziós környezet jobban modellezi, de elengedhetetlenek az állatmodellek is a kutatásokban. Az állatkísérletekben tumorképződést indukálunk vagy humán daganatsejteket juttatunk az állatok szervezetébe, ami rendkívül hasznos, de nem tudja tökéletesen megmutatni, hogyan viselkednek a tumorsejtek a humán szövetekben, a nem tumoros humán sejtek melletti szöveti mikrokörnyezetben” – mutatott rá dr. Sebestyén Anna a 3D bionyomtatás daganatkutatásban várható előnyeire.
 Egy daganat kezelése nagy kihívást jelent. A tumor a beavatkozások, a gyógyszeres kezelés és a progresszió közben folyamatosan változik. A 3D bionyomtatóval létrehozott szövetek, speciális mikrofluidika rendszerekkel kiegészítve a jövőben alkalmasak lehetnek ennek modellezésére is. Hosszabban fenntartott 3D szövetszerű struktúrákban vizsgálni lehet, hogyan szelektálódik ki egy-egy agresszív daganatsejt-klón, hogyan válnak bizonyos tumorok rezisztenssé a kezeléssel szemben. Előbbieken túl a 3D modellek előnyei a gyógyszerfejlesztésben is jól hasznosíthatók: sokkal hatékonyabban tesztelhetők ilyen körülmények között az új, potenciális daganatellenes hatóanyagok, mint 2D sejtkultúrákban. „A végső klinikai vizsgálatokat és a megelőző állatkísérleteket persze nem helyettesíthetik ezek az új típusú vizsgálatok, de csökkenthetik a szükséges állatkísérletek és a sikertelen fázisvizsgálatok számát, hiszen segítségükkel jobban szelektálhatók a várhatóan hatásos hatóanyagok. Így a jelenlegi gyógyszerfejlesztési vizsgálatok nagy költségei is csökkenthetők lehetnek a jövőben”– tette hozzá a kutató.
Egy daganat kezelése nagy kihívást jelent. A tumor a beavatkozások, a gyógyszeres kezelés és a progresszió közben folyamatosan változik. A 3D bionyomtatóval létrehozott szövetek, speciális mikrofluidika rendszerekkel kiegészítve a jövőben alkalmasak lehetnek ennek modellezésére is. Hosszabban fenntartott 3D szövetszerű struktúrákban vizsgálni lehet, hogyan szelektálódik ki egy-egy agresszív daganatsejt-klón, hogyan válnak bizonyos tumorok rezisztenssé a kezeléssel szemben. Előbbieken túl a 3D modellek előnyei a gyógyszerfejlesztésben is jól hasznosíthatók: sokkal hatékonyabban tesztelhetők ilyen körülmények között az új, potenciális daganatellenes hatóanyagok, mint 2D sejtkultúrákban. „A végső klinikai vizsgálatokat és a megelőző állatkísérleteket persze nem helyettesíthetik ezek az új típusú vizsgálatok, de csökkenthetik a szükséges állatkísérletek és a sikertelen fázisvizsgálatok számát, hiszen segítségükkel jobban szelektálhatók a várhatóan hatásos hatóanyagok. Így a jelenlegi gyógyszerfejlesztési vizsgálatok nagy költségei is csökkenthetők lehetnek a jövőben”– tette hozzá a kutató.
A molekuláris biológiai és diagnosztikai technikák intenzív fejlődése mellett az elmúlt években elérhetővé vált in vitro modellrendszer fejlesztések, köztük a 3D bionyomtatás a XXI. század elején forradalmasíthatják a sejt- és tumorbiológiai kísérleteket. Ez újabb eszközöket ad a precíziós medicina és az egyénre szabott kezelések fejlődéséhez – mutatott rá dr. Sebestyén Anna.
Szabó Ádám
Fotó: Kovács Attila – Semmelweis Egyetem
A cikket a Semmelweis Egyetem Kommunikációs Igazgatósága tette közzé.