|
Semmelweis Egyetem Budapest, Magatartástudományi Intézet Levelezési cím: Dr. Bódizs Róbert ÖSSZEFOGLALÁSA szerotonin és az alvás-ébrenlét állapotok szoros és komplex összefüggése rendkívüli elméleti és gyakorlati jelentoségu kérdéskör. A probléma ellentmondásossága és a rendelkezésre álló szakirodalmi adatok fényében sem kelloképpen tisztázott jellege azonban nehezíti az e témakörrel kapcsolatos ismeretek rendszerezését és hasznosítását. A szerotonin alvásszabályozásban játszott szerepének áttekintése során kiemelt figyelmet szentelünk az akut ébreszto és a hosszabb távon érvényesülo, cirkadián fázist módosító illetve az alvás homeosztatikus szabályozását moduláló funkciók elkülönült elemzésének. A receptortípusok szerinti differenciált hatások szempontjából az 5-HT1A/7 és 5-HT3 receptorok cirkadián ritmicitást illetve REM alvást szabályozó/ moduláló, valamint az 5-HT2A receptoroknak az alvás homeosztázisában, az alvásintenzitásban, az ultradián alvásorganizációban és az alvás folyamatosságában játszott szerepei kerülnek a tanulmány elemzéseinek fókuszába. Ugyanakkor a szerotonin, a neurális plaszticitás és az alvási orsózás kölcsönös összefüggésére utaló adatok új megvilágításba helyezhetik a szerotoninerg rendszeren keresztül ható gyógyszerek hatásmechanizmusának és hatásainak neuropszichofarmakológiai jellemzését. KULCSSZAVAK: 5-HT2A receptor, alvásstádiumok, lassú-hullámú alvás, biológiai órák, cirkadián ritmus, delta aktivitás IN WAVES’ PARLANCE: SEROTONIN AND THE SLEEP OSCILLATIONSThe tight and complex relationship between serotonin and the sleep-waking states has special theoretical and practical importance. There are many available scientific data regarding this issue, but the apparently contradictory and insufficiently clarified nature of the problem holds up the systematization and exploitation of this knowledge. While reviewing the role of serotonin in sleep regulation a special attention to the differentiation between the immediate arousing and the slowly developing circadian phase resetting and sleep homeostatic functions of serotonin is paid. As regarding the differentiation of receptor subtypes the article focuses on circadian rhythm and REM regulatory/modulatory functions in relation with 5-HT1A/7 and 5-HT3 receptors, as well as on sleep homeostasis, sleep intensity, ultradian sleep organization, and sleep continuity in relation with 5-HT2A receptors. Moreover, there is suggestive data for the reciprocal interactions between serotonin, neural plasticity and sleep spindling, which might provide new insights in the neuropsychopharmacological characterization of the mechanisms of action and effects of drugs acting through the serotoninergic system. KEYWORDS: 5-HT2A receptor, sleep stages, slow-wave sleep, biological clocks, circadian rhythm, delta rhythms BevezetésAz alvásszabályozásban szerepet játszó központi idegrendszeri struktúrák feltárására irányuló erofeszítéseik során Michel Jouvet és munkacsoportja felismerték, hogy az agytörzsi magvak nem pusztán és nem elsosorban anatómiai lokalizációjuk, hanem különösképpen kémiai jellegzetességeik szerint különülnek el abban a neurofiziológiai rendszerben, amely az alvás-ébrenlét állapotok megjelenését befolyásolja vagy meghatározza (Jouvet, 1969, 1972). A léziós kísérletek mellett ekkor már neurofarmakológiai eljárások bovítették azt a módszertani repertoárt, ami természetesen egybeesett az agyi monoaminerg rendszerek leíró jellemzésével (Dahlström, Fuxe, 1964) és az úgynevezett nedves neurofiziológia elterjedésével (Jouvet, 1999). A szerotonin alvásszabályozásban játszott kiemelt szerepét kezdetektol fogva számos érv támogatta (Portas és mtsai 2000; Ursin, 2002). Ugyanakkor egyre több olyan gyógyszer jelent meg és terjedt el a pszichiátriai gyakorlatban, amely egyben a szerotoninerg rendszerre is hatott. Ez minden bizonnyal szerepet játszott az érdeklodés fenntartásában, figyelemreméltó azonban, hogy egyik gyógyszer sem rendelkezett markáns altató (hipnotikus) hatással és a szerotonin prekurzora, a triptofán sem váltotta be a hozzá fuzött reményeket. Az egymásnak ellentmondó eredmények és következtetések folyományaként tulajdonképpen csak annyi maradt meg a szakmai köztudatban, hogy a szerotonin fontos szerepet játszik az alvásszabályozásban, aminek közhely jellege nem segít sem a gyakorlatilag is hasznosítható ismeretek meghatározásában, sem pedig a további elméleti ismeretek bovítésében. A szerotonin számos magatartásforma szabályozásában részt vesz: az alvás mellett a szexuális viselkedés, az agresszió, a táplálékfelvétel, a hangulat és egyes kognitív folyamatok is jelentos szerotoninerg befolyás alatt álló magatartáselemek. Fönnmarad azonban a kérdés: hogyan vesz részt a szerotonin az alvás szabályozásban? Miként befolyásolja ez a klinikai gyakorlatot? Összefügg-e a szerotonin alvásszabályozásban játszott szerepe más magatartáselemek formálásában játszott szerepével és hogyan? Ezeknek a kérdéseknek a tisztázása véleményem szerint nem képzelheto el a hagyományos nedves neurofiziológia – vagyis a neurotranszmitterek és neuromodulátorok dinamikus interakciójának – fogalmi keretei között. A receptor altípusok szelektív vizsgálata elkerülhetetlen, de önmagában szintén számos kérdést megválaszolatlanul hagyó megközelítés. Igazából szinte minden olyan újabb keletu áttekintés, amely a szerotonin és az alvás kapcsolatának feltárását tuzi ki célul a szerotoninból indul ki (Portas és mtsai 2000; Ursin 2002), némileg figyelmen kívül hagyva a kérdés másik és csak rendszer szintu neurofiziológiában megragadható oldalát. Utóbbi vonatkozásban nélkülözhetetlen lehet nemcsak az alvásszabályozás alapveto elemeinek tisztázása, de az idegrendszer oszcillációs és idozítéssel kapcsolatos funkcionális sajátosságainak a figyelembevétele. A szerotonin: az alvás vagy az ébrenlét transzmittere?A szerotonin alvásszabályozásban játszott szerepére Michel Jouvet hívta föl a figyelmet azoknak a kísérleti eredményeknek az alapján, amelyek a szerotoninszintézist gátló p-klorofenilalanin álmatlanságot eloidézo hatását mutatták macskákban (Jouvet, 1969). Igaz, ekkor már rendelkezésre állt néhány megfigyelés, amely szerint a szerotonin alvást kelto hatású: macskák intraventrikuláris 5-HT injekcióra alvástöbblettel reagáltak (Bradley, 1958; Koella és Czicman, 1966). Ezzel egybehangzó a raphe magok léziója nyomán kialakuló inszomnia megfigyelése, szintén macskákban (Jouvet, 1969). A szerotoninhiány pótlása ellensúlyozta az álmatlanság tünetét. Mivel a hatás többféle módszerrel és különbözo laboratóriumokban megfigyelheto volt, Jouvet megfogalmazta a szerotoninerg alvásteóriát, amely szerint a szerotonin az alvás, és azon belül is elsosorban a REM alvás kialakulásában szerepet játszó neurotranszmitter (Jouvet, 1969). A további kutatások azonban az elmélettel és az addigi eredményekkel gyökeresen ellentétes eredményeket hoztak. Egyrészt a macskáknál megfigyelt jelenségek patkányoknál sokkal kevésbé voltak reprodukálhatóak, másrészt pedig a unit aktivitás regisztrálásának David H. Hubel (1957) által megalkotott módszere révén csakhamar kiderült: a szerotoninerg neuronok aktivitása ébrenlétben a legmagasabb, NREM alvásban jelentosen csökken, REM alvásban pedig gyakorlatilag megszunik (McGinty és Harper, 1976). Az in vivo mikrodialízis révén történo extracelluláris szerotoninszint-mérés ezzel teljes mértékben megegyezo eredményt hozott (Portas és mtsai, 2000). Késobb a szelektív szerotonin visszavételt gátló antidepresszánsok megjelenése is egyértelmuvé tette annak a megállapításnak a helytállóságát, miszerint a szerotonin- transzmisszió fokozása nem csakhogy nem altató hatású, hanem éppenséggel ébreszto és eroteljesen gátolja a REM alvás megjelenését (Wilson és Argyropoulos, 2005). Ezzel a 180 fokos fordulattal a szerotoninerg alvásteória álma az 1970-es évek második felében szertefoszlott (Jouvet, 1999; Ursin, 2002). Elokerültek azok az eddig figyelmen kívül hagyott megfigyelések is, miszerint a szerotoninszintézis gátlása vagy a raphe magok léziója átmenetileg inszomniát okoznak ugyan, de késobb ezekben a modellekben az alvás fokozatosan újra megjelenik, pedig a szerotoninerg rendszer károsodása maradandó vagy tartós. Ugyanakkor továbbra is vannak olyan megfigyelések, amelyek szerint a szerotonin némely receptora kifejezetten alváskelto hatású. Ilyen például az 5-HT1A receptor alváskelto hatásáról szóló közlés ecetmuslicában (Yuan és mtsai, 2006). Az ellentmondások feloldását a farmakológusok a receptor altípusok eltéro hatásaiban, az elsosorban alvásszabályozással foglalkozó elméleti kérdésekben érdekelt alváskutatók pedig emellett a hatások idoi lefutásában és részben a fajspecifikusságban látták. Az alábbiakban ezeknek a tényezoknek a figyelembevételével vizsgáljuk a szerotonin és az alvás kapcsolatát. Alvás, szerotonin, biológiai órákVitán felülinek tekintheto az a megállapítás, mely szerint az alvás-ébrenlét állapotok váltakozása sajátos idozíto mechanizmusok szerint történik. A biológiai idozítésben vannak homokóra mechanizmusok, amelyek az ébren illetve alvással töltött idotartamot használattól-függo módon „mérik” és vannak oszcillációk, amelyek az idozítést a napszak függvényében vagy attól függetlenül, de alapvetoen ciklikusan valósítják meg. A homeosztatikus alvásszabályozás és a szerotonin A neurális rendszerek használattól-függo vagy tapasztalattól-függo módon szabályozott lokális alvásállapotainak sorában a szerotonin ébrenlét- és mozgásfüggo felszabadulása feltételezhetoen aktiválja a hypothalamus hypnogén hatású neuropeptidjeinek termelodését, amelyek késleltetett felszabadulása szerepet játszhat az alvás inicializálásában. A vazoaktív intesztinális polipeptid (VIP) illetve a kortikotropinszeru középso lebenyi peptid (corticotropine-like intermediate lobe peptide, CLIP) két olyan hipotalamikus neuropeptid, amely bizonyítottan hipnotikus hatásokkal rendelkezik illetve részben szerotoninerg kontroll alatt áll. Ezenkívül mindketto eroteljesen REM-kelto hatású is egyben (Jouvet, 1999). A szerotonin homeosztatikus alvásszabályozásban játszott szerepét, akárcsak a szerotonin késleltetett alváskelto hatását támogatja az a megfigyelés is, amely szerint az 5-HT2A receptor-deficiens patkányokban a tartós ébrenlét hatására kialakuló, NREM alvásban megfigyelheto delta EEG fokozódás elmarad a vad törzsekben hasonló beavatkozás hatására kialakuló delta EEG fokozódás mértékétol (Popa és mtsai, 2005). Úgy tunik tehát, hogy az ébrenlét alatti szerotoninerg aktivitás kedvezo, valamilyen formában elokészíti az alvást, és az adatok arra utalnak, hogy a szerotonin a noradrenalinnal együtt (Cirelli és mtsai, 2005) részt vehet az alvás homeosztatikus szabályozásában. Tekintve, hogy az 5-HT2A receptorok fontos szerepet játszanak a memóriában (de Quervain és mtsai 2003), a noradrenalin pedig a szinaptikus plaszticitásban (Cirelli és mtsai, 2005), ezek a megfigyelések jól illeszkednek a homeosztatikus alvásszabályozás azon elképzeléseinek sorába is, amelyek az ébrenléti aktivitással összefüggo alvásnyomás-fokozódást a tanulással és végso soron a szinaptikus plaszticitással hozzák összefüggésbe, feltételezve, hogy ez utóbbiak okozzák az alvásban mérheto delta EEG növekedést (Cirelli és mtsai, 2005). Ugyanakkor a szerotonin a noradrenalinnal és a GABA-val együtt részt vesz az ébrenlét finomhangolásának folyamatában, amennyiben az éberség fenntartásában és fokozásában alapveto szerepet játszó orexinerg rendszer általi stimulációjára negatív feedbackkel válaszol, ezzel mintegy önszabályozó kört képezve (Hajak és Geisler, 2003). A cirkadián ritmusok kapcsolata a szerotoninerg transzmisszióval
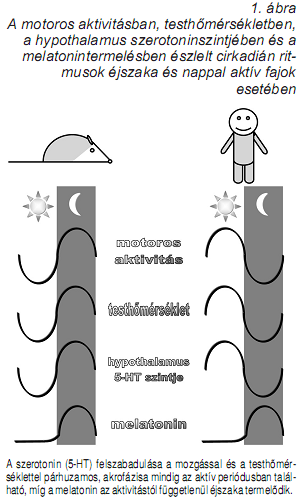
Az alvásszabályozás cirkadián ritmusokkal kapcsolatos komponense az ember és más nappal aktív fajok esetében éjszaka, míg az éjszaka aktív fajok esetében nappal fokozza az alváskésztetést. A cirkadián ritmus pacemakere a nucleus suprachismatis, a hypothalamus opticus chiasma fölötti régiójában található, ami az alvás-ébrenlét állapotok idozítése mellett és azzal összefüggésben a testhomérséklet és a melatonin-termelés szabályozásában is fontos szerepet játszik. Míg a melatonin nappal és éjszaka aktív fajok esetében egyaránt éjszaka termelodik, a testhomérséklet és a hypothalamus szerotonin-forgalma egyaránt az aktív periódusokban (nappal aktív fajok esetében nappal, éjszaka aktív fajok esetében pedig éjszaka) éri el csúcsát (Challet, 2007). A szerotonin-forgalom nem csak a testhomérséklettel és az ébrenléttel párhuzamos cirkadián ritmicitású, de a testmozgással is szoros összefüggésben áll (1. ábra), és mint ilyen a mozgás kronobiotikus (phase-shifting) hatásainak neurokémiai modulátora. Ez a hatás a nucleus suprachiasmatis szerotoninerg raphe inputjai révén, az 5-HT1A és az 5-HT7 receptorokon keresztül valósul meg. Ez utóbbiak fokozzák a nucleus suprachiasmatis neuronjaiban a PER gének expresszióját, és a szubjektív nappalok (nappal aktív fajok esetében nappal, éjszaka aktív fajok esetében pedig éjszaka) idején hatva fázist eloretoló (phase advance) hatással bírnak. A cirkadián fázist eloretoló hatásokat a szelektív szerotonin visszavételt gátló fluoxetin és az 5-HT1A/7 agonista 8-OH-DPAT adagolás esetében is megfigyelték (Challet, 2007). A szerotonin cirkadián alvásszabályozásban játszott szerepe tehát hasonlít a homeosztatikus alvásszabályozás esetében megfogalmazotthoz, amennyiben az ébrenlét alatt aktív, de az alvásperiódust elokészíto sajátosságokkal bír. Szerotonin, ultradián ritmusok és alvás A szerotoninerg raphe magok neuronjainak unit aktivitásában megfigyelt állapotfüggoség (McGinty és Harper, 1976) egy fontos mérföldko volt a modern alváskutatásban. Ez a megfigyelés nemcsak a NREM-REM ciklus szabályozásának kibontakozó félben lévo teóriájának (McCarley és Hobson, 1975) további részleteire, de az álmodás és a tudat neurokémiai vonatkozásaira (Hobson és McCarley, 1977), valamint az antidepresszánsok hatásmechanizmusának némely fontos aspektusára (Vogel, 1983; Adrien, 2000) is ráirányította a figyelmet. Az a tény, hogy egy több percen át tartó REM fázis teljes ideje alatt csend uralkodik a szerotoninerg rendszerben potenciálisan rendkívüli idegélettani és magatartásszabályozási relevanciával bírhat. Az ultradián alvásciklusok és a szerotoninerg aktivitás közötti szoros kapcsolatot nemcsak a unit aktivitással, hanem az in vivo mikrodialízissel végzett vizsgálatok is megerosítették: magas extracelluláris szerotoninszintet mindig ébrenlétben, a legalacsonyabbat mindig REM alvásban tapasztalták, míg a NREM alvás a ketto között volt elhelyezheto (Portas és mtsai, 2000). A humán adatok tekintetében rendelkezésre áll egy mutét elotti kivizsgálás során epilepsziás beteg oldalsó agykamrájából in vivo mikrodialízis révén nyert idosor, amely a szerotoninszint és a NREM-REM ciklusok kapcsolatát megerosíti: alacsony ventrikuláris szerotoninszinteket mindig a REM alvásban mértek, az idosor pedig párhuzamos volt az alvásciklusokkal (Zeitzer és mtsai, 2002). Továbbá a szelektív szerotonin visszavételt gátló antidepresszívumok erélyes REM-gátló hatása közvetetten szintén megerosíti a szerotonin és a REM alvás közötti antagonisztikus kapcsolatot (Vogel, 1983; Adrien, 2000; Wilson és Argyropoulos, 2005). Az alvásszabályozás ultradián komponensének máig széles körben elfogadott modellje a kölcsönös interakció elmélet, amely a szerotoninnak, a noradrenalinnal együtt permisszív szerepet tulajdonít a REM alvási fázisok megjelenésében. Eszerint a nucleus raphe dorsalisban a szerotonin a REM alvást kikapcsoló (REM-off) rendszer része, amely gátlás alatt tartja a cholinerg REM-on rendszert mindaddig, amíg a NREM fázisok végén aktivitása nagymértékben lecsökken és a REM-on rendszer aktívvá válik. A REM-on rendszer ezután szerepet játszik a REM- off rendszer újbóli muködésbe hozásában, ezért kölcsönös az interakció, bár ez a hatás késleltetett, és ezért maradhatunk hosszabb ideig is REM alvásban. A dorsalis raphe szerotoninerg aktivitásának csökkenését GABAerg mechanizmusok valósítják meg (Pace-Schott és Hobson, 2002), ugyanakkor a REM-on rendszer gátlása az 5-HT1A receptorok közvetítésével történik (McCarley és mtsai, 2000). A tudat neurokémiájával és az álmodás idegélettanával kapcsolatos elképzelések jelentos mértékben építenek a szerotoninerg rendszer REM alvás ideje alatti aktivitáscsökkenésére/muködéskimaradására (Hobson és mtsai 2000), többek között azért is, mert ehhez hasonló raphe unitaktivitás-csökkenést a pszichedelikus szerek (DMT, LSD) képesek kiváltani állatmodellekben (Rogawski és Aghajanian, 1981), a pszichedelikus transz és az álom hasonlósága pedig a vizuális hallucinációk tekintetében kézenfekvo. A NREM és a REM fázisok alternálásának szabályozása mellett a szerotonin részt vesz az egészséges alvási architektúra kialakításában, nevezetesen az éjszaka második felében és az alvás végén tapasztalható REM dominancia kialakításában az 5-HT3 receptorok stimulálása révén (Staner és mtsai, 2001). A szerotonin, az EEG spektrum és az alvás mikrostruktúrájaAz alvásintenzitás és az alvás folytonossága Az alvás minoségének egyik legfontosabb mutatója az alvás mélysége vagy – az alvásszabályozás terminusaiban megfogalmazva – az alvás intenzitása. A fogalom operacionalizálása többnyire az EEG delta hullámok valamilyen quantitatív mutatóján alapul: több delta tevékenység (lassú hullámú aktivitás) mélyebb, intenzívebb alvást jelent, ami tehát a NREM alvásfázissal kapcsolatos mutató. A delta tevékenység éjszakai alvás során tapasztalt eloszlása jellegzetesnek mondható: delta EEG tevékenység dominálja az alvás elso harmadát, azon belül is az alvásciklusok közepén érve el a maximális értékeket. Ezen kívül a delta EEG tevékenység fázisos formában, az alvás úgynevezett ébredési instabilitását kifejezo ciklikusan váltakozó mintázat EEG képében, reaktív lassú hullám epizódok és/vagy K-komplexusok formájában jelenik meg (Bódizs, 2000). Az alvás homeosztatikus szabályozásáról szóló részben láttuk, hogy a szerotonin az 5-HT2A receptorokon hatva facilitálja az ébrenlét ideje alatti alvásnyomás-fokozódást, aminek következménye az alvás ideje alatti delta tevékenységben tapasztalható növekedés (Popa és mtsai, 2005). A szerotonin-transzmisszió cirkadián ritmusa ugyanakkor a nappalihoz képest csökkent éjszakai szerotoninerg aktivitásban jut kifejezésre (Challet, 2007), ami némileg megtartott NREM fázisokban és teljesen megszunik a REM fázisokkal összefüggoen (McGinty és Harper, 1976).Míg a nappali szerotoninerg aktivitás facilitálja az alvásintenzitás növekedését, az éjszakainak inkább permisszív szerepe lehet, mivel az akut 5-HT2A/2C receptor-stimuláció markánsan csökkenti a delta tevékenységet (Monti, Jantos 2006), az 5-HT2A/2C, illetve újabb megfigyelések szerint az 5-HT6 antagonisták pedig erélyes delta tevékenységet növelo szerek (Kantor és mtsai, 2002; Viola és mtsai, 2002; Morarity és mtsai, 2008). A habituális alvásperiódus ideje alatt ható nem szelektív 5-HT2A/ 2B/2C antagonista ritanserin a delta tevékenység és a lassú hullámú alvásban töltött ido fokozása mellett (Dugovic és mtsai 1989; Idzikowski 1989; Sharpley és Cowen 1995) az alvás-szerkezet normalizálása irányában is hat, amennyiben a lassú hullámok ultradián ritmicitását és 80-120 perces ciklusokban való visszatérését segíti elo rosszul alvó fiatal vizsgálati személyeknél (Viola és mtsai 2002). A lefekvés elott bevett ritanserin ezenkívül a K-komplexusok számát is fokozhatja alacsony K-komplexus-számmal jellemezheto disztímiás populációban (Paiva és mtsai, 1989), illetve ellensúlyozza a benzodiazepin agonista nitrazepam lassú hullámú alvást csökkento hatását (Idzikowski, 1989). Az 5-HT2A/2C antagonista hatással bíró antidepresszívumok vonatkozásában nemcsak a lassú hullámú alvásban töltött ido fokozódását, hanem az alvás folyamatosságának és a szubjektív alvásminoségnek a javulását is leírták (Sharpley és Cowen, 1995). A szelektív ligandokkal kapcsolatos vizsgálatok arra utalnak, hogy a fenti hatásokkal elsosorban az 5-HT2A és részben az 5-HT2C receptorok hozhatók összefüggésbe (Kantor és mtsai, 2004), bár utóbbiak egyben a szerotonin akut szorongást kelto hatását is közvetítik (Bagdy és mtsai, 2001). Az 5-HT2B receptorok a fentiekkel ellentétes hatásprofilt mutatnak (Kantor és mtsai 2004). Mindez ugyanakkor arra is utal, hogy a fiziológiás alvásprofil szempontjából a direkt vagy indirekt 5-HT2A agonisták hatásának nappali periódusra való korlátozódása volna kívánatos. Az 5-HT2A antagonistákra ugyanennek a fordítottja igaz: éjszaka hatva idéznek elo optimális alvási hatást, nappal viszont – amennyiben a knock-out modellen nyert eredmények általánosíthatónak bizonyulnak – csökkentik az alvásnyomás természetes akkumulálódását. Utóbbi vonatkozásban természetesen nemcsak az 5-HT2A antagonisták, hanem az inverz agonisták is szóba jöhetnek, amelyek esti adagolása után szintén leírták az alvásfolytonosság és az szubjektív alvásminoség javulását, akárcsak a lassú hullámú alvásban töltött ido növekedését (Rosenberg és mtsai 2008; Abbas, Roth 2008). Tekintve, hogy az alvás folyamatossága és a lassú hullámú alvásban töltött ido dönto szerepet játszik az alvás restoratív és pihenteto hatásának kialakításában, a jelenleg vizsgált 5-HT2A antagonisták és inverz agonisták (APD125, volinanserin, eplivanserin, pruvanserin, pimavanserin) új korszakot nyithatnak az inszomnia kezelésében (Teegarden és mtsai, 2008). Ez egyben a benzodiazepin-agonisták döntoen lassú hullámú alvást csökkento vagy azt csak sajátos esetekben növelni képes profilja (Bódizs, 2006) miatt fennálló klinikai problémák megoldását is új megvilágításba helyezheti. Ugyanakkor a primer inszomnia szorosan összefügg a neuroticizmussal mint személyiségvonással, akárcsak az eltérési negativitással becsült thalamo-fronto-corticalis hiperreaktivitással. Feltételezik, hogy ezek mögött a csökkent talamikus gating vagy a neurotranszmitter-rendszerek egyensúlyának zavara áll (Wang és mtsai, 2001). A neuroticizmus viszont pozitív korrelációban áll a frontolimbikus 5-HT2A receptorsuruséggel (Frokjaer és mtsai, 2008), ezért az 5-HT2A receptorok antagonistái vagy inverz agonistái impliciten magukban hordozzák az inszomnia kezelésének indirekt, a neuroticizmus egyes aspektusainak redukcióján keresztüli módozatát is. Szerotonin, alvási orsók, neurális plaszticitás: egy feltárásra váró probléma Az alvásminoség nem pusztán az alvásintenzitás vagy az EEG képben mérheto delta hullámok függvénye. Az alvás legnagyobb részét ugyanis a 2. stádium teszi ki (Bódizs, 2000), ami már csak ezért sem tekintheto pusztán felületes, a lassú hullámú (3-4. stádiumok) vagy a REM fázis bevezeto szakaszának. A 2. stádiumú alvás egyik sajátosságát a K-komplexusokat a fentiekben már említettük. Egy másik a 2. stádiumra jellemzo fázisos EEG jegy az alvási orsózó tevékenység, aminek az alvás folyamatosságában (Nicolas és mtsai, 2001), az idegrendszeri plaszticitási folyamatokban (Timofeev és mtsai, 2002) és a neurokognitív funkciókban (Clemens és mtsai, 2005, 2006; Bódizs és mtsai, 2005, 2008) lehet kiemelt szerepe. Ez arra indította az alváskutatókat, hogy az alvási orsókkal, mint az alvás egyik – a delta hullámok és a REM fázis mellett – legfontosabb fiziológiai jellemzojével foglalkozzanak. A kérdést némileg bonyolítja a delta hullámok és az alvási orsók közötti részleges antagonizmus, vagyis hogy a delta hullámú alvás fokozódása az orsók csökkenésével jár. Ha viszont az orsókat csak a természetes módon amúgy is alacsony delta aktivitással jellemezheto 2. stádiumú alváson belül és nem a teljes NREM szakaszokban vizsgáljuk, akkor egy fontos és az alvás funkciója szempontjából potenciálisan kiemelkedo jelentoségu EEG jeggyel van dolgunk. A szerotonin és az alvási orsók kapcsolata egy jórészt még feltárásra váró terület, de az elso szakirodalmi közlések nyomán úgy tunik, érdemes a kérdést közelebbrol is megvizsgálni. A monoamin visszavételt gátló antidepresszánsok alvási orsókra és memóriakonszolidációra gyakorolt hatásainak egyik egészséges fiatal önkénteseken végzett vizsgálatában azt találták, hogy míg a szelektív szerotonin visszavételt gátló fluvoxamin (50 mg) és a szelektív noradrenalin visszavételt gátló reboxetin (2 mg) egyaránt csökkentik a REM alvásban töltött idot, addig a gyors (> 13 Hz) alvási orsók számát csak a reboxetin fokozza szignifikánsan. A lefekvés elott tanult motoros szekvenciák („finger tapping” teszt) alvás alatti konszolidációját viszont mindkét hatóanyag szignifikánsan javította (a placebohoz képest), igaz az alvás alatti teljesítményfokozódás a gyors alvási orsókkal állt kapcsolatban, tehát a fluvoxamin inkább csak azon kísérleti alanyoknál idézett elo javulást, akiknek a gyors orsózását is fokozta, míg az orsózást érintetlenül hagyó alanyoknál a javulás sokkal kisebb mértéku volt (Rasch és mtsai, 2008). Egy poszttraumás stressz betegeken végzett alváslaboratóriumi vizsgálatban ezzel szemben azt találták, hogy a szelektív szerotonin visszavétel gátlókkal folytatott kezelés szignifikánsan emelkedett alvásiorsó-gyakorisággal járt együtt, aminek potenciális klinikai jelentosége a fenti, alvási orsókkal összefüggésbe hozott funkciók alapján figyelemreméltó (Dotan és mtsai, 2008). Fontos megjegyezni, hogy ebben az esetben természetesen tartós kezelés közben, és nem az egy esti dózis bevételét követoen végzett alvásvizsgálatról volt szó. A hatás idegélettani magyarázatával még nem próbálkoztak a szakirodalomban, de a nucleus reticularis thalami neuronjainak szerotonin és a noradrenalin hatására történo depolarizációja és ritmikus oszcillációs aktivitása (Destexhe és mtsai 1994; Steriade, 2004) mindkét fenti eredményt megmagyarázhatja. Ez egyben új összefüggésben is értelmezhetové teszi a szerotonin az alvás és a depresszió kapcsolatát, mivel a hagyományosan kémiai egyensúlyzavarnak tekintett depresszió fogalom helyett elotérbe került alternatív elmélet a neurális hálózatok konnektivitási és információfeldolgozási zavarából vezeti le a hangulatzavart, aminek korrigálására a kémiai beavatkozás a plaszticitási folyamatok fokozása révén teremt lehetoséget (Castrén, 2005).Mivel az alvási orsók a neurális hálózatok plaszticitásának jelei és formálói is egyben (Bódizs, 2008), az alvási orsók antidepresszívumok általi fokozása a folyamat egyik potenciális biomarkerét képezheti. ÖsszefoglalásEzen összefüggéseket figyelembe véve érdemes újragondolni a bevezetoben föltett kérdést, vagyis azt, hogy a szerotonin az alvás vagy az ébrenlét transzmittere-e? Az adatok ugyanis arra utalnak, hogy rövid távú akut hatásait tekintve a szerotonin mindenképpen az ébrenlét transzmittere, amennyiben – néhány sajátos tulajdonságától eltekintve – az agyi ébresztorendszerek szerves része (Jones, 2005). Hosszú távú hatásait figyelembe véve azonban a fenti tézis megváltoztatása, finomítása válik szükségessé: napközben vagy a habituális aktivitási periódusban hatva a szerotonin az alvás transzmittere, amennyiben elokészíti azt (homeosztatikus alvásnyomás fokozása, cirkadián phase resetting). A korai eredmények ellentmondásosságát a hagyományos receptortípusok szerinti differenciálás mellett így is érdemes újragondolni, hiszen a raphe magok léziói vagy a szerotonin szintézisének gátlása hosszú távú hatásokat is képesek kifejteni és meggátolhatják vagy csökkenthetik az alvásnyomás kialakulásának folyamatát, míg a unit vizsgálatok és a mikrodialízissel készült mérések következetesen az akut hatásnak megfelelo, arousal-függo szerotoninerg aktivitást jeleznek. Ez a koncepció megfelel az egyik elso vizsgálatban leírtaknak is: Bradley (1958) intraventrikulárisan szerotonint adott be macskáknak, amire az állatok alvástöbblettel reagáltak, igaz csak egy kezdeti aktivációs fázist követoen. Vagyis a szerotonin már ekkor, ebben a kísérletben sem egyszeruen az alvás transzmitterének, hanem az ébrenlétet követo alvás transzmitterének, az ébrenlét-alvás ciklus neuromodulátorának bizonyult. Ugyanakkor biztató adatok támogatják azt a feltételezést, miszerint a szerotonin és a neuroplaszticitás kapcsolatát a jövoben érdemes az alvás-függo oszcillációk függvényében is vizsgálni, amely vélhetoen szintén a lassan kialakuló, hosszú távú hatások és az alváshatások ma még nem kelloképpen feltárt összekapcsolódása révén történik. IRODALOMAbbas A, Roth BL (2008). Pimavanserin tartrate: a 5-HT2A inverse agonist with potential for treating various neuropsychiatric disorders. Expert Opin Pharmacother 9(18): 3251–9. Adrien J (2000). The regulation of REM sleep by 5-HT and its relationship to endogenous depression. In: AA Borbély, O Hayaishi, TJ Sejnowski, JS Altman (Eds): The regulation of sleep. Strasbourg: HFSP, p. 131–9. Bagdy G, Graf M, Anheuer ZE, Modos EA, Kantor S (2001). Anxiety-like effects induced by acute fluoxetine, sertraline or m-CPP treatment are reversed by pretreatment with the 5-HT2C receptor antagonist SB- 242084 but not the 5-HT1A receptor antagonist WAY-100635. Int J Neuropsychopharmacol 4(4): 399– 408. Bódizs R (2000). Alvás, álom, bioritmusok. Budapest: Medicina. Bódizs R, Kis T, Lázár AS, Havrán L, Rigó P, Clemens Z, Halász P (2005). Prediction of general mental ability based on neural oscillation measures of sleep. J Sleep Res 14(3):285–92. Bódizs R (2006). Alvásszabályozás és hipnotikumok: a benzodiazepin-receptor agonisták hatása. Neuropsychopharmacol Hung 8(3):113–25. Bódizs R (2008). Differenciálpszichológia alvásélettani megközelítésben: az egyéni EEG mintázatok jelentosége. Magyar Pszichológiai Szemle 63(1): 29–50. Bódizs R, Lázár AS, Rigó P (2008). Correlation of visuospatial memory ability with right parietal EEG spindling during sleep. Acta Physiol Hung 95(3):297–306. Bradley PB (1958). The effects of 5-hydroxytryptamine on the electrical activity of the brain and on behavior in the conscious cat. In: GP Lewis (Ed): 5-Hydroxytryptamine. London: Pergamon Press, p. 214. Castrén E (2005). Is mood chemistry? Nat Rev Neurosci 6:241–6. Challet E (2007). Minireview: Entrainment of the suprachiasmatic clockwork in diurnal and nocturnal mammals. Endocrinology 148(12):5648–55. Cirelli C, Huber R, Gopalakrishnan A, Southard TL, Tononi G (2005). Locus ceruleus control of slow-wave homeostasis. J Neurosci 25(18): 4503–11. Clemens Z, Fabó D, Halász P (2005). Overnight verbal memory retention correlates with the number of sleep spindles. Neuroscience 132(2): 529–35. Clemens Z, Fabó D, Halász P (2006). Twenty-four hours retention of visuospatial memory correlates with the number of parietal sleep spindles. Neurosci Lett 403(1-2):52–6. Dahlström A, Fuxe K (1964). Evidence for the existence of monoamine neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons. Acta Physiol Scand 62(Suppl.):232. De Quervain DJ-F, Henke K, Aerni A, Coluccia D, Wollmer MA, Hock C, Nitsch RM, Papassotiropoulos A (2003). A functional genetic variation of 5-HT2a receptor affects human memory. Nat Neurosci 6: 1141–2. Destexhe A, Contreras D, Sejnowski TJ, Steriade M (1994). Modeling the control of reticular thalamic oscillations by neuromodulators. NeuroReport 5:2217–20. Dotan Y, Suraiya S, Pillar G (2008). [Sleep spindles in post traumatic stress disorder: significant importance of selective serotonin reuptake inhibitors]. Harefuah 147(10): 763–7, 839–40. Dugovic C, Wauquier A, Leysen JE, Janssen PAJ (1989). Role of serotonin S2 receptors in the control of sleep-wakefulness states in the rat. In: A Wauquier, C Dugovic, M Radulovacki (Eds): Slow wave sleep: physiological, pathophysiological and functional aspects. New York: Raven Press. p. 183–96. Frokjaer VG, Mortensen EL, Nielsen FA, Haugbol S, Pinborg LH, Adams KH, Svarer C, Hasselbalch SG, Holm S, Paulson OB, Knudsen GM (2008). Frontolimbic serotonin 2A receptor binding in healthy subjects is associated with personality risk factors for affective disorder. Biol Psychiatry 63(6):569–76. Hajak G, Geisler P (2003). Orchestrating sleep-wake functions in the brain. Nat Med 9(2):170–1. Hobson JA, McCarley RW (1977). The brain as a dream state generator: an activation-synthesis hypothesis of the dream process. Am J Psychiatry 134(12):1335–48. Hobson JA, Pace-Schott EF, Stickgold R (2000). Toward a cognitive neuroscience of conscious states. Behav Brain Sci 23(6):793–842. Hubel DH (1957). Tungsten microelectrode for recording from single units. Science 125:549–50. Idzikowski C (1989). The effects of ritanserin and seganserin on human slow wave sleep. In: A Wauquier, C Dugovic, M Radulovacki (Eds): Slow wave sleep: physiological, pathophysiological and functional aspects. New York: Raven Press. p. 197–215. Jones B (2005). From waking to sleeping: neuronal and chemical substrates. Trends Pharmacol Sci 26(11):578–86. Jouvet M (1969). Biogenic amines and the states of sleep. Science 163: 32-41. Jouvet M (1972). The role of monoamines and acetylcholine containing neurons in the regulation of the sleep waking cycle. Ergebn Physiol 64:166–307. Jouvet M (1999). Sleep and serotonin: an unfinished story. Neuropsychopharmacology 21:24S–27S. Kantor S, Jakus R, Bodizs R, Halasz P, Bagdy G (2002). Acute and long- term effects of the 5-HT2 receptor antagonist ritanserin on EEG power spectra, motor activity, and sleep: changes at the light-dark phase shift. Brain Res 943(1):105–11. Kantor S, Jakus R, Balogh B, Benko A, Bagdy G (2004). Increased wakefulness, motor activity and decreased theta activity after blockade of the 5-HT2B receptor by the subtype- selective antagonist SB-215505. Br J Pharmacol 142(8):1332–42. Koella WP, Czicman JS (1966). Mechanism of the EEG-synchronizing action of serotonin. Am J Physiol 211:926–34. McCarley RW, Hobson JA (1975). Neuronal excitability modulation over the sleep cycle: a structural and mathematical model. Science 189(4196):58–60. McCarley R, Strecker RE, Thakkar M, Porkka-Heiskanen T (2000). Adenosine and 5-HT as regulators of behavioural state. In: AA Borbély, O Hayaishi, TJ Sejnowski, JS Altman (Eds): The regulation of sleep. Strasbourg: HFSP, p. 103–12. McGinty D, Harper RM (1976). Dorsal raphe neurons: depression of firing during sleep in cats. Brain Res 101:569. Monti JM, Jantos H (2006). Effects of the serotonin 5-HT2A/2C receptor agonist DOI and of the selective 5-HT2A or 5-HT2C receptor antagonists EMD 281014 and SB-243213, respectively, on sleep and waking in the rat. Eur J Pharmacol 553:163–70. Morairty SR, Hedley L, Flores J, Martin R, Kilduff TS (2008). Selective 5HT2A and 5HT6 receptor antagonists promote sleep in rats. Sleep 31(1):34–44. Nicolas A, Petit D, Rompré S, Montplaisir J (2001). Sleep spindle characteristics in healthy subjects of different age groups. Clin Neurophysiol 112(3):521–7. Pace-Schott EF, Hobson JA (2002). The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat Rev Neurosci 3(8):591–605. Paiva T, Arriaga F, Wauquier A, Lara E, Largo R, Leitao JN (1989). Changes in sleep disturbances of dysthymic patients induced by ritanserin. In: A Wauquier, C Dugovic, M Radulovacki (Eds): Slow wave sleep: physiological, pathophysiological and functional aspects. New York: Raven Press. p. 217–34. Popa D, Léna C, Fabre V, Prenat C, Gingrich J, Escourrou P, Hamon M, Adrien J (2005). Contribution of 5-HT2 receptor subtypes to sleep- wakefulness and respiratory control, and functional adaptations in knock-out mice lacking 5-HT2A receptors. J Neurosci 25(49):11231–8. Portas CM, Bjorvatn B, Ursin R (2000). Serotonin and the sleep/wake cycle: special emphasis on microdialysis studies. Prog Neurobiol 60(1):13–35. Rasch B, Pommer J, Diekelmann S, Born J (2008). Pharmacological REM sleep suppression paradoxically improves rather than impairs skill memory. Nat Neurosci doi: 10.1038/nn.2206 Rogawski MA, Aghajanian GK (1981). Serotonin autoreceptors on dorsal raphe neurons: structure-activity relationships of tryptamine analogs. J Neurosci 1(10):1148–54. Rosenberg R, Seiden DJ, Hull SG, Erman M, Schwartz H, Anderson C, Prosser W, Shanahan W, Sanchez M, Chuang E, Roth T (2008). APD125, a selective serotonin 5-HT(2A) receptor inverse agonist, significantly improves sleep maintenance in primary insomnia. Sleep 31(12):1663–71. Sharpley AL, Cowen PJ (1995). Effect of pharmacologic treatments on the sleep of depressed patients. Biol Psychiatry 37(2):85–98. Staner L, Linker T, Toussaint M, Danjou P, Roegel JC, Luthringer R, Le Fur G, Macher JP (2001). Effects of the selective activation of 5-HT3 receptors on sleep: a polysomnographic study in healthy volunteers. Eur Neuropsychopharmacol 11(4):301–5. Steriade M (2004). Slow-wave sleep: serotonin, neuronal plasticity and seizures. Arch Ital Biol 142:359–67. Teegarden BR, Al Shamma H, Xiong Y (2008). 5-HT(2A) inverse-agonists for the treatment of insomnia. Curr Top Med Chem 8(11):969–76. Timofeev I, Grenier F, Bazhenov M, Houweling AR, Sejnowski TJ, Steriade M (2002). Short- and medium-term plasticity associated with augmenting responses in cortical slabs and spindles in intact cortex of cats in vivo. J Physiol 542 (Pt 2): 583–98. Ursin R (2002). Serotonin and sleep. Sleep Med Rev 6(1):57–69. Viola AU, Brandenberger G, Toussaint M, Bouhours P, Paul Macher J, Luthringer R (2002). Ritanserin, a serotonin-2 receptor antagonist, improves ultradian sleep rhythmicity in young poor sleepers. Clin Neurophysiol 113(3):429–34. Vogel GW (1983) Evidence for REM sleep deprivation as the mechanism of action of antidepressant drugs. Prog Neuropsychopharmacol Biol Psychiatry 7(2-3):343–9. Wang W, Zhu SZ, Pan LC, Hu AH, Wang YH (2001). Mismatch negativity and personality traits in chronic primary insomniacs. Funct Neurol 16(1):3–10. Wilson S, Argyropoulos S (2005). Antidepressants and sleep: a qualitative review of the literature. Drugs 65(7):927–47. Yuan Q, Joiner WJ, Sehgal A (2006). A sleep-promoting role for the drosophila serotonin receptor 1A. Curr Biol 16:1051–62. Zeitzer JM, Maidment NT, Behnke EJ, Ackerson LC, Fried I, Engel J, Wilson CL (2002). Ultradian sleep-cycle variation of serotonin in the human lateral ventricle. Neurology 59:1272–4. |