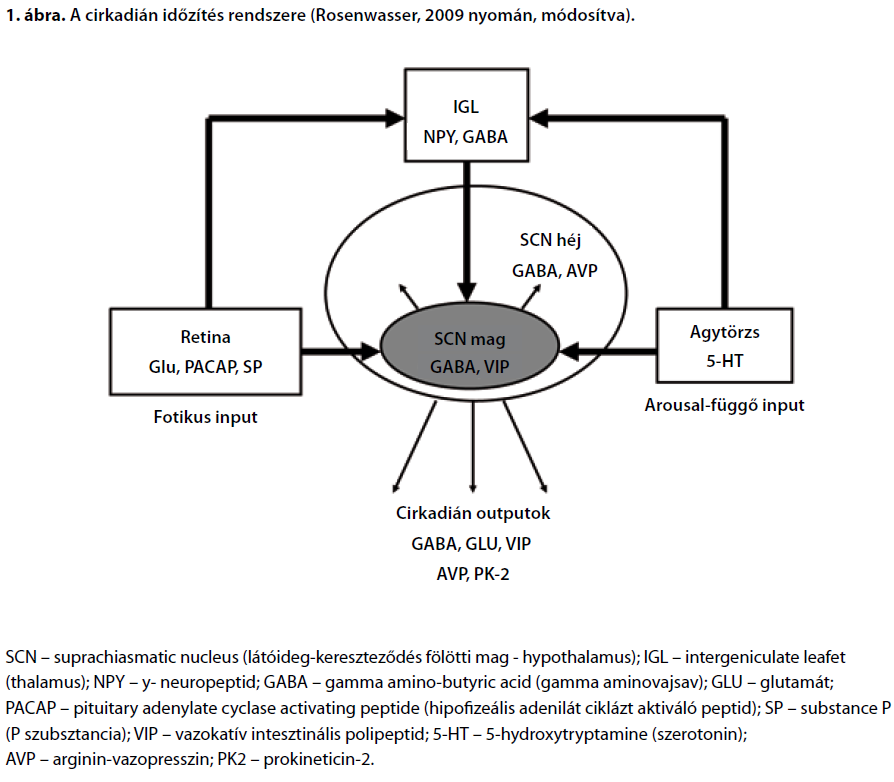
Bódizs Róbert1,2,Purebl György2 és Rihmer Zoltán3 1MTA-BME Kognitív Tudományi Kutatócsoport, Budapest 2Semmelweis Egyetem, Magatartástudományi Intézet, Budapest 3Semmelweis Egyetem, Klinikai és Kutatási Mentálhigiénés Osztály, Budapest ABSZTRAKTEgyre több bizonyíték támogatja azt a megállapítást, miszerint a cirkadián ritmicitás a hangulat szabályozásának fontos eleme és a hangulatzavarok kialakulásának mozgatórugója is egyben. A pozitív és a negatív hangulati összetevők, valamint az éberség diurnális ritmusai a cirkadián fázistól és a homeosztatikus alvásszabályozástól, illetve a kettő harmonikus interakciójától függenek. A depresszióban leírt és a hangulatot magyarázó kronopatológiai eltérések egyaránt lehetnek fázis előretolódás és fázis-késés eredői, ugyanakkor egyöntetűen a cirkadián ritmus fázisa és az alvás-ébrenlét ciklus időzítése közötti eltolódással, rendellenes fázisszöggel jellemezhetőek. A rendellenes fázisszög kialakulása kronotipológiai és egyéb alkati tényezők kedvezőtlen környezeti hatásokkal (zeitgeberek inadekvát jellege) való interakciójából eredeztethető, ugyanakkor felborítja a hangulat szabályozásának diurnális komponensei közötti harmóniát, ezáltal szélsőséges hangulati állapotok kialakulását implikálva. A depresszió és más affektív kórképek kronoterápiájának célja a cirkadián reszinkronizáció, vagyis a megbomlott egyensúly helyreállítása, ami gyógyszeres, életmódbeli és sajátos kronoterápiás beavatkozások révén érhető el. Kulcsszavak: depresszió, kronobiológia, cirkadián ritmusok, hangulat ABSTRACTMood, mood fluctuations and depression: role of the circadian rhythmsThe statement that circadian rhythmicity is an important component of mood regulation as well as a drive of mood disorders is supported by a growing body of evidence. Diurnal rhythms of the positive and negative components of mood as well as of the level of arousal depend on the circadian phase, the homeostatic sleep regulatory mechanisms and the harmonic interaction of the circadian and homeostatic processes. The chronopathological symptoms which are typical in depression and explain the blunted mood of depressive patients are of the phase-advance and phase-delay type characterized by a misalignment between the circadian rhythms and the sleep-wake schedules, best described by the phase-angle alterations. The abnormal phase angle between circadian rhythms and the timing of the sleep period could emerge from an interaction of the chronotypes and other constitutional factors with adverse environmental effects (inadequate zeitgebers) leading to a disharmony between the diurnal components of mood regulation and consequent extreme mood states. The aim of the chronotherapies of depression and of other affective disorders is that of resynchronizing the circadian rhythms or in other words to reconstitute the harmony between these subsystems. Pharmacological approaches, lifestyle changes and specific chronotherapeutic interventions might help to achieve this goal. Keywords: depression, chronobiology, circadian rhythms, mood A depresszió etiológiájára vonatkozóan számos pszichoszociális, neurokognitív és idegélettani elképzeléssel rendelkezünk, olyan átfogó modell azonban, mely többé-kevésbé egységes konceptuális keretben foglalja össze mindezeket, eddig még nem született. Ugyanakkor mind a hétköznapi hangulat normális kereteken belül történő váltakozása, mind a legtöbb depresszióban észlelhető jelenség jól értelmezhető a cirkadián ritmicitás fogalomkörében. Meggyőző bizonyítékok támogatják azt a megállapítást, miszerint major depresszióban a hangulatzavar súlyossága korrelál a cirkadián ritmus felborulásának mértékével(Emens és mtsai, 2009). Az alábbiakban megpróbáljuk áttekinteni, milyen eddigi adatok támasztják alá a cirkadián ritmus és az alvás-ébrenlét ciklus, mint két különálló, a hangulat pozitív és negatív komponenseit befolyásoló folyamat és a depresszió összefüggését. A cirka dián ritmusokról általában A prediktív homeosztázis Az élővilágban számos példát ismerünk a prediktív homeosztázis jelenségére, vagyis olyan, vélhetően az evolúciós sikert fokozó mechanizmusok kialakulására, amelyek előre felkészítik a szervezetet a várható környezeti változásra (pl. apály-dagály vagy nappal-éjszaka). A sikeres alkalmazkodást nagymértékben fokozhatja például a nappalok és az éjszakák várható egymásutániságára való felkészülés, amit az élővilágban a cirkadián ritmusok biztosítanak. Mivel az ember döntően vizuális támpontok alapján tájékozódó lény, továbbá a nappalok és az éjszakák közötti leginkább megbízhatónak tekinthető különbség a fényerősségben tapasztalható, a cirkadián ritmusok és a fényérzékelés folyamatai egymással szoros kapcsolatban álló rendszerek. Cirkadián pacemaker Az emlősök körében a fő cirkadián pacemaker a hypothalamus SCN magja (suprachiasmatic nucleus), amely inputokat kap a retinából a retinohypothalamicus tractuson keresztül, a thalamus egyes magvaiból is (geniculohypothalamicus tractus), illetve a középagyi raphe magokból és más agytörzsi, bazális előagyi és a hypothalamus egyes sejtcsoportjaiban föllelhető cholinerg és aminerg rendszerektől. Az SCN inputjait képező rostok arginin-vazopresszint (AVP), vazoaktív intesztinális polipeptidet (VIP) és gamma-aminovajsavat (GABA) termelő neuronokkal teremtenek szinaptikus kapcsolatot, de az aktivitás-nyugalom ritmus cirkadián mintázata vélhetőleg kiemelkedő jelentőséggel bíró humorális inputok révén, a keringésben lévő melatonin és más, eddig még nem kellőképpen tisztázott neuromodulátorok vagy hormonok közvetítésével is regulálódik (Rosenwasser, 2009). Az emberi SCN mintegy 50 000 neuronjában specifikus gének, a Per1, Per2, Per3, továbbá a Cry1 és Cry2 expresszálódnak, a génexpresszió szabályozása pedig egy negatív feedback hurok révén, a BMAL1/CLOCK regulátorok sejtmagba vándorolt Per1-3 és Cry1-2 fehérjekomplexumok általi periodikus gátlásával történik (Wulff és mtsai, 2009). Az SCN neuronjai ezért sejttenyészetekben is cirkadián mintázat szerint válnak aktívvá (Klisch és mtsai, 2006), in vivo viszont az SCN kimenetei révén számos más központi idegrendszeri struktúra és perifériás oszcillátor (például a máj) ritmikus tevékenységét is kontrollálják. Az SCN szinaptikus outputjai (melyekben általában a GABA, az AVP és a VIP képezik a fő neurotranszmittereket) között fellelhetőek eg A tobozmirigy szerepe Az SCN és a corpus pineale közötti szoros funkcionális kapcsolat a melatonin sajátos szerepével kapcsolatos. A melatoninprodukció ugyanis erőteljes cirkadián meghatározottságú, és mint ilyen az SCN által vezérelt, ugyanakkor fény révén gátolható is. A keringésben lévő melatonin melatonin-receptorokhoz való kapcsolódása révén visszahat az SCN működésére, befolyásolja a génexpressziót, és mint ilyen markáns kronobiotikus hatást fejthet ki. Természetes körülmények között a melatonin-produkció éjszaka és sötétben történik, a mesterséges világítás adta lehetőségek és más cirkadián ritmust felborító hatások azonban jelentősen módosíthatják ezt (Bódizs, 2009a). Diurnális ritmusok, azaz napszakos mintázatok Az SCN outputjai, illetve a perifériás és centrális oszcillátorok komplex interakciójának eredői jellegzetes napszakos mintázatot hoznak létre számos endokrin és anyagcserefolyamatban, illetve a neurális hálózatok működésmódjában, működéskészségében. Előbbire a cirkadián ritmusok által meghatározott hormontermelés(a melatonin mellett a kortizol és az ACTH) és a magtemperatúra cirkadián mintázata, utóbbira pedig az egyes alvás-ébrenlét állapotok megjelenésének valószínűségei, valamint az EEG ritmusok, illetve a kognitív és az emocionális változók napszaktól függő patternjei szolgáltatják a legfontosabb példákat. Időtagoló tényezők (zeitgeberek) A cirkadián ritmusokra és az SCN aktivitására ható külső tényezők közül kiemelkedő jelentőséggel bírnak azok az ingerek, amelyek képesek a ritmikus tevékenység fázisának átállítására, illetve természetes körülmények között a fázisviszonyok stabilizálására vagy normalizálására. Az ilyen jellegű ingereket zeitgebereknek nevezzük. A fő zeitgeber a fény, amely közvetlenül is hat (retinohypothalamicus tractus), de közvetett, melatoninprodukciót gátló hatása révén érvényesülő kronobiotikus hatása is igen erőteljesnek mondható. A nem-fotikus zeitgeberek közé tartoznak a reguláris szociális interakciók és a testmozgás (motoros aktivitás), amelyek a geniculohypothalamicus tractus, illetve az agytörzsi és bazális előagyi inputok révén képesek befolyást gyakorolni az SCN neuronjainak aktivitására. Pszichiátriai szempontból kiemelkedő jelentőségű a szociális interakciók zeitgeber jellege, illetve az a farmakológiai megfigyelés, amely szerint a szerotonin az 5-HT1A és 5-HT7 receptorokon hatva markáns endogén kronobiotikus tényező (Bódizs, 2009b).
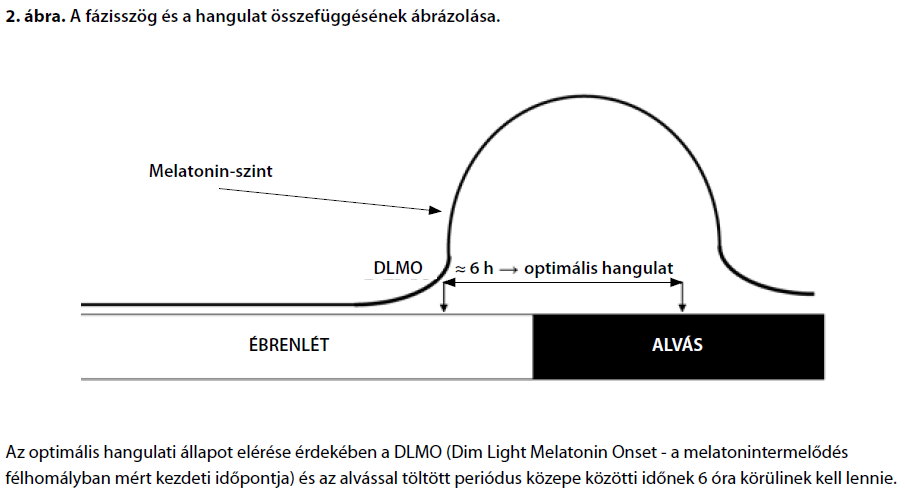
Az alvás homeosztázisának szerepe Az élettani és viselkedéses változók napszakfüggősége, vagyis az azokban megfigyelhető diurnális változás nem csak a cirkadián inputot, hanem az alvásszükségletet, az utolsó alvásepizód óta eltelt időt is tükrözik, tükrözhetik. Az alvás homeosztázisa jelenlegi ismereteink szerint nagyrészt lokális, a neuroncsoportok, neuronhálózatok vagy akár kérgi kolumnák szintjén is megjelenő folyamat. Ez azt jelenti, hogy az igénybevételtől függően egyes egymással szorosabb kapcsolatban álló neuroncsoportok az organizmus viselkedésének szintjén megjelenő alvástól némileg disszociáltan is átléphetik az ébrenlétszerű és alvásszerű üzemmód határát. Továbbá az alvás ideje alatt sem tekinthető minden neuronhálózat egyszerre, egyidejűleg alvásállapotban lévőnek. Az alvás statisztikai jelenség is, ami azt jelenti, hogy a viselkedéses alvás nagyszámú neurális hálózat alvás-üzemmódba váltásaként fogható föl. Ebből az is következik, hogy eltérő napszakokban, az utolsó alvásperiódus óta eltelt idő, illetve a funkcionális igénybevétel függvényében eltérő számú neurális hálózat vesz részt effektíven a viselkedés szervezésében, az összpontosítást és szellemi jelenlétet lehetővé tevő nagyfokú éberségtől a súlyos kialvatlanság miatti elégtelen, esetleg szétesett viselkedés-organizációig vagy a mély alvásig terjedő skálán(Krueger és Obál, 1993; Krueger és mtsai, 2008). Az említett lokális alváshomeosztázis mechanizmusát illetően nagy valószínűséggel feltételezhetjük, hogy amögött parakrin módon ható és a szinaptikus jelátvitel intenzitásától függő tényezők – nagy valószínűség szerint az adenozin és egyes szomnogén citokinek (interleukin-1β, tumornekrózis-faktor-α) – állnak(Krueger és mtsai, 2008). A fentiek módszertani következménye az, hogy a diurnális vagy napszakos változások megléte önmagában még nem engedi meg a cirkadián ritmusra való következtetések levonását, hiszen azok egyszerre tükrözik a cirkadián ritmust és az alvás homeosztázisának hatását. Csak a két tényezőt egyszerre kontrolláló specifikus módszertannal jellemezhető kronobiológiai vizsgálatok (pl. konstans rutin protokoll, erőltetett deszinkronizáció, stb.) engedik meg az elkülönült elemzést. Ennek hiányában ugyanakkor empirikusan megállapítható egyes változók napszakos megoszlása hagyományos alvás-ébrenlét mintázat mellett, ami azonban egyes klinikai mintákban (pl. depresszióban) zavart lehet. A hangulat diurnális ritmusa A hangulat és az affektivitás dimenzionális szerkezete A hangulat, illetve az affektivitás dimenzionális szerkezetére vonatkozó vizsgálatok mára nagyrészt megcáfolták a negatív és a pozitív hangulati állapotok egyazon tengelyen való megjelenítésének szükségességét. Nem csak a klinikumban – egyes bipoláris kórképekben –, de az egészséges mintákon végzett tereptanulmányokban is rámutattak, hogy a pozitív és a negatív affektivitás önálló hangulati dimenziók, amelyek inkább csak a szélsőséges övezetben, illetve magas arousalszint mellett változnak egymással ellentétesen, amúgy inkább egymástól függetlennek tekinthetőek (Reich és Zautra, 2002). A pozitív hangulati dimenzióval jellemezhető emberek aktívnak, mámorosnak, lelkesnek és életerősnek írják le magukat. A negatív dimenzión mért magas pontszámot a félelem, a harag, a csüggedtség vagy az idegesség jellemzik. Ennek a koncepciónak természetesen a neurobiológiai alapjai is életszerűbbek, mint az egydimenziós megközelítésnek. Beszélnek ugyanakkor az általános éberség/serkentettség dimenziójáról is (arousal), ami szintén csak részben független az előbbiektől, ugyanakkor napszakfüggősége tekintetében elsőrend Az éberség diurnális ritmusa A hangulatban és a közérzetben tapasztalható napszakfüggő ingadozások a dolog természetéből adódóan elsősorban az éberség vonatkozásában számottevőek. A szubjektív éberség a cirkadián moduláció és a homeosztatikus alvásreguláció kettős befolyása alatt áll. A diurnális ingadozás mintázata természetes körülmények között (hagyományos alvás-ébrenlét mintázat) a nap folyamán a reggeli ébredést követően növekvő, majd estefelé csökkenő éberségszintben nyilvánul meg. Ezt a dinamikát egy koradélutáni, átmenetinek mondható csökkenés töri meg (cirkaszemidián ritmus). Legtöbb embernél az éberség a déli órákban éri el a csúcsát, a késő délutáni/kora esti csúcs másodlagos. Utóbbi vonatkozásban, illetve a csúcsok időzítésében viszont nagyfokú eltérések vannak a napszakos preferenciák (reggeli-esti vagy pacsirta-bagoly típusok) függvényében. A fenti diurnális ingadozás cirkadián komponense vélhetően a magtemperatúrával szinkron éberségritmust jelent. Folyamatos ébrenlét állapotában vagy az alvás-ébrenlét ciklus és a cirkadián ritmus mesterséges disszociálásának körülményei között ugyanis az éberség szintje pozitívan korrelál a magtemperatúrával. Ez utóbbi a nap folyamán, kb. hajnali 4 órától kezdődően (nagy egyéni eltérésekkel) növekszik, és nagyjából este 8 körül éri el a csúcsát. A magtemperatúra tehát bizonyos fokig a cirkadián arousal biológiai markerének is tekinthető. Ezzel a cirkadián hatással összegződik az alvás homeosztázisának hatása, ami hozzávetőlegesen az ébren töltött idővel arányosan csökkenő éberséget diktál. A két hatás eredője eltérő lehet akkor, ha az egyes komponensek eltérő súllyal, illetve eltérő módon vesznek részt a kialakításában. A megzavart vagy elégtelen alvás fokozhatja a homeosztatikus (ébren töltött időtől függő) komponenst, míg a cirkadián ritmus fázisában tapasztalható egyéni különbségek vagy a cirkadián moduláció erőssége a napszaktól függő hatást módosíthatják (Bódizs, 2000). A pozitív affektusok diurnális ritmusa A hangulati állapotok pozitív dimenziója mentén megfigyelt diurnális ingadozás vonatkozásában meghatározónak mondható az a fordított U-alakú görbe, amit egymástól függetlenül több vizsgálat eredménye nyomán is leírtak (Wood és Magnello, 1992; Watson és mtsai, 1999; Murray és mtsai, 2002; Peeters és mtsai, 2006). Némely vizsgálatban következetesen délelőtt 10 és 12 óra között figyeltek meg a pozitív affektus diurnális megoszlásának mintázatában megmutatkozó csúcsot (Wood és Magnello, 1992), mások ennél kicsit később (Watson és mtsai, 1999). A nemi különbségekkel kapcsolatos eredmények ellentmondóak: a férfiak erőteljesebb napszakfüggő hangulatingadozására utaló közlés mellett (Adan és Sánchez-Turet, 2001) ennek részben az ellenkezőjére utaló eredmények is vannak (Birchler-Pedross és mtsai, 2009). Idős korban csökken a napszakos hangulatingadozás amplitúdója (Monk és mtsai, 1992). Az ébren töltött idő és a napszak (cirkadián fázis) elkülönült elemzését lehetővé tevő vizsgálatok egyértelműen rámutattak, hogy a pozitív hangulati dimenzió diurnális ingadozását elsősorban cirkadián és nem homeosztatikus tényezők determinálják (Boivin és mtsai, 1997; Birchler-Pedross és mtsai, 2009), jóllehet a két tényező között szignifikáns és nem-additív jellegű interakció is megfigyelhető. Utóbbi lényegében azt jelenti, hogy az alvás-ébrenlét ciklus cirkadián ritmushoz képest történő kismértékű eltolódása is számottevő hangulatváltozást vonhat maga után. A cirkadián ritmus és az alvás-ébrenlét ciklus egymáshoz viszonyított fázisszöge más eredmények szerint is jelentős hatással van a pozitív affektivitásra: eszerint a korai fekvés, de nem a korai ébredés az, ami a másnapi pozitív hangulat megbízható, és az össz-alvásidőnél fontosabbnak látszó előrejelzője (Totterdell és mtsai, 1994). Mindez arra utal, hogy az optimális hangulat az alvás-ébrenlét ciklus és a cirkadián ritmus egy jellegzetes fázisszögéhez kötött. Ennek optimumát a különböző vizsgálatok eredményei nyomán hozzávetőlegesen 6 órában adják meg, ami a félhomályban mért melatonintermelődési periódus kezdete és az aktigráfiával becsült alvásperiódus közepe közötti időtartamra vonatkozik (2. ábra). Ettől eltérő fázisszöget mérnek hangulatzavarokban, a kronoterápia sikere pedig a fázisszög normalizálásának függvénye (Lewy és mtsai, 2006). A pozitív affektivitás diurnális mintázatának döntően cirkadián meghatározottsága viszont távolról sem jelenti azt, hogy az alvás homeosztázisa egyáltalán ne hatna a hangulatnak erre az összetevőjére. A kialvatlanság miatti magas alvásnyomás (40 órás alvásmegvonás) szignifikánsan csökkenti a well-being pontszámokat és ez a hatás idős személyek és nők esetében kifejezettebb (Birchler-Pedross és mtsai, 2009). Ennek értelmében megállapítható, hogy a pozitív hangulati állapot hagyományos körülmények között a nap, illetve az ébren töltött periódus közepén vagy annál némileg korábban valószínűsíthető. Ennek a jelenségnek egy értelmezését adja az az elképzelés, amely szerint az evolúciós múltban a jutalmazás maximális valószínűsége a nappali órákban és világosban csúcsosodott ki, a hangulat diurnális mintázata pedig a prediktív homeosztázis egyik esete, vagyis az erre adott filogenetikus válasz (Watson és mtsai, 1999; Peeters és mtsai, 2006). A filogenetikus magyarázatot erősíti az agyi jutalmazó (dopaminerg) rendszer és a cirkadián ritmus újabban feltárt, szoros, kétirányú kapcsolata is (Webb és mtsai, 2009).
Van-e a negatív affektivitásnak diurnális ritmusa? A pozitív affektivitással szemben a negatív affektusok sajátossága, hogy azok jellegzetes diurnális mintázattal nem rendelkeznek (Watson és mtsai, 1999; Murray és mtsai, 2002; Peeters és mtsai, 2006), illetve cirkadián ritmicitásukra vonatkozóan sem találtak meggyőző bizonyítékokat (Murray és mtsai, 2002). Mindez azt sugallja, hogy a pozitívval szemben a negatív hangulati állapotok megjelenésének tendenciája nem függ a napszaktól, alapvetően alacsony szintű negatív affektív tónus jellemzi a napot, viszont az aktuális veszélyek és kihívások által a rendszer bármikor könnyen mobilizálható (Peeters és mtsai, 2006). Az alvásmegvonás, vagyis a homeosztatikus alvásszabályozó rendszer aktiválásának a negatív (depresszív) hangulatra gyakorolt hatását a kronotípusok modulálják: reggeli (pacsirta) típusú alanyokban a teljes alvásmegvonás fokozza, esti (bagoly) típusúakban csökkenti a depresszív hangulatot (Selvi és mtsai, 2007). Pszichopatológiai implikációk: hangulatzavarok és cirka dián ritmicitás A depresszió tüneteinek diurnális jellege A cirkadián ritmusok és a hangulat kapcsolata számos ponton érintik a hangulatzavarok kérdéskörét. Ezek közül a klinikai gyakorlat szempontjából talán legfontosabb a major depresszióban megfigyelhető diurnális hangulatingadozás, illetve a tüneti kép súlyosságának napszakfüggősége. Major depresszió esetén az állapot „típusos” napszaki ingadozása, vagyis a reggeli mélypont és a délutánra, estére javuló állapot (amely nemcsak a hangulatra, hanem az étvágyra és a szellemi, ill. fizikai aktivitásra is vonatkozik), rendkívül fontos diagnosztikus jel, és még viszonylag enyhe depresszió esetén is annak primér (vagyis „biológiai”) jellegére utal. Egyes felv A cirkadián preferencia egyénekre jellemző típusa (pacsirta vs. bagoly típus) érdekes összefüggéseket mutat a depresszió klinikai tüneteivel. Egy száz, ambulánsan észlelt unipoláris major depressziós betegről szóló vizsgálat szerint a betegek 20-20 százaléka volt a reggeli (pacsirta), ill. az esti (bagoly) típusba besorolható, míg a betegek 60 százalékára az ilyen preferencia nem volt jellemző. A reggeli (pacsirta típusú) cirkadián preferenciát mutató betegekkel összehasonlítva az esti (bagoly) típusúak depressziója szignifikánsan súlyosabb volt és ez a különbség szignifikáns maradt akkor is, ha az elemzésből a Hamilton Depresszió Skála alvás-tételét kihagyták. Mindezeken túl az esti típusú betegek szignifikánsan magasabb pontszámokat értek el az öngyilkossági gondolatok, a munka- és aktivitáscsökkenés, a szorongás, valamint a paranoid tünetek vonatkozásában is. Az esti típusú depressziós betegeknél szignifikánsan gyakoribb volt a melankóliás jelleg mint a reggeli típusúaknál (94% vs. 52%), de a két csoport között nem volt különbség az alvási paramétereket (alvás-latencia, alvásidő, a szubjektív alvásminőség, az alváshatékonyság, stb.) illetően, kivéve természetesen azt a tényt, hogy a reggeli típusú betegek (per definíció) több mint két órával előbb aludtak el, illetve ébredtek fel (Gaspar-Barba és mtsai, 2009). Túl azon, hogy a bagoly típusú emberek depressziója tehát egészében véve súlyosabb, mint a pacsirta típusúaké, náluk sokkal gyakrabban figyelhető meg a depresszió szezonális (téli) incidenciája (Murray és mtsai, 2003), ami jól megfelel annak a megfigyelésnek, hogy a hangulat cirkannuális fluktuációja elsősorban szintén az esti típusú egyéneknél figyelhető meg még egészséges populációban is (Natale és mtsai, 2005). Úgy tűnik tehát, hogy az esti kronotípus depresszióra és szorongásos betegségekre hajlamosító tényező, míg a reggeli típus inkább protektív e tekintetben (Tonetti és mtsai, 2009). Optimális cirkadián fázisszög, hangulat és depresszió A fenti megfigyelésekkel szorosan összekapcsolható a másik explicit klinikai fontosságú tényező, a depressziós hangulat és a cirkadián diszreguláció, pontosabban az alvás-ébrenlét ciklus és a cirkadián ritmus közötti fázisszög kérdésköre. Ennek oka, hogy az esti kronotípusú személyek cirkadián ritmusa a reggeli kronotípusúakénál kevésbé rigid, környezeti változásokkal könnyebben változtatható, ugyanakkor gyakran már önmagában egy fáziskésést takar (Roenneberg és mtsai, 2003). Kezdetben inkább csak a szezonális depresszióval kapcsolatban írtak le egyértelmű összefüggéseket, azaz a 6 órától jelentősen eltérő fázisszöget, illetve annak normalizálása esetén a hangulat javulását, de legújabban a nem szezonális depresszió tekintetében is biztató megfigyelések vannak. Mindez legegyszerűbben úgy összegezhető, mint a nem megfelelő időben történő alvás hangulatra gyakorolt negatív hatása (Lewy és mtsai, 2006; Lewy, 2007; Lewy, 2009; Emens és mtsai, 2009). Ezt a jelenséget a belső koincidencia modellje is leírja, rámutatva, hogy a tényleges alvásperiódus és a cirkadián ritmus deszinkronizálódása többnyire cirkadián phase shift-tel magyarázható, amit a depresszióban gyakran megfigyelt rendellenesen rövid REM-látencia is alátámaszt. Utóbbi a habituális alvásperiódushoz képest előretolódott cirkadián ritmust fejez ki (Wehr és Wirz-Justice, 1981). Mindamellett, az aktuális kutatások arra utalnak, hogy az affektív kórképekkel jellemezhető populációban, a fenti kronotípusokra vonatkozó érveléseinkkel összhangban számszerűen dominálnak a fázis-késéssel jellemezhető páciensek (Lewy, 2009). Számos modell értelmezi tehát a hangulatzavarokat cirkadián ritmuszavarként. Mivel az SCN egyik vélhető humorális kimenete a PK2, megvizsgálták a PK2 receptor gén és a hangulatzavarok lehetséges kapcsolatát. Egy Japánban, kis mintán végzett vizsgálat szerint a PK2 receptor gén és a hangulatzavarok között szignifikáns összefüggés van, amit azonban más populációkon is meg kell erősíteni ahhoz, hogy általánosítható megállapítást tehessünk ezen együttjárás vonatkozásában (Kishi és mtsai, 2009). A feltételezést mindenesetre erősíteni látszik az az állatkísérletes eredmény, amely szerint az intracerebroventrikuláris PK2 infúzió szorongásra és depresszióra utaló hatásokat idéz elő a különböző viselkedéses tesztekben (Li és mtsai, 2009). Alvászavar és cirkadián ritmuszavar depresszióban A megzavart alvás-ébrenlét ciklicitás részben a cirkadián diszreguláció egyik tünete, amely különös jelentőséggel bír a depresszió patofiziológiájában. Az alvászavar (az esetek többségében inszomnia, ritkábban hiperszomnia) nemcsak a depressziós epizód egyik legkoraibb és leggyakoribb tünete, hanem a szuicidium szignifikáns prediktora (Fawcwett és mtsai, 1990; McGirr és mtsai, 2007). Unipoláris depressziós betegekre inkább az inszomnia, míg bipoláris depresszióra elsősorban a hiperszomnia jellemző (Goodwin és Jamison, 2007). Aktuálisan major depressziós epizódban szenvedő betegeknél a DSM-IV atípusos tünetek (a hangulat reaktivitása, hiperszomnia, hiperfágia, „laden paral A kezeletlen inszomnia és megzavart alvás a depresszió egyik legfontosabb rizikófaktora, illetve a kezeletlen alvászavarok egyik leggyakoribb szövődménye a depresszió (Ohayon, 2007; Taylor és mtsai, 2003, 2007). Mindezeken túlmenően a depresszió tüneteinek kialakulásában és a lefolyás alakulásában rendkívül fontos szerepet játszanak az alvással és a cirkadián ritmussal összefüggő faktorok. Ezek a faktorok függetlenek a depresszió típusaitól és altípusaitól, hiszen unipoláris depresszióban és bipoláris zavarban egyaránt észlelhetők, és úgy tűnik, a depresszió általános jellemzői közé tartoznak, lefolyástól és súlyosságtól függetlenül. A depresszió tünettanának megfelelően a cirkadián ritmus egyes komponenseinek zavarai is heterogén képet mutathatnak depresszióban, úgy tűnik azonban, hogy maga a cirkadián ritmus zavar a depresszió általános jellemzője (Feldman-Naim és mtsai, 1997; Gordijn és mtsai, 1994; Tolle és Goetze, 1987). Fontos adat továbbá, hogy depresszióban a clock-gének diszfunkciója is megfigyelhető (Turek, 2007). Patofiziológiai modellek: milyen cirkadián folyamatok játszhatnak közvetlen patomechanisztikus szerepet a depresszióban? Melatonin receptor hatás A nem megfelelően ellenőrzött tartalmú és hatású, többnyire recept nélkül kapható melatoninkészítményekkel kapcsolatos, időnként a médiában tapasztalható lelkes hírverés nagyon megnehezíti azt, hogy tisztán lássuk igazi jelentőségét és valódi használhatóságát: ennek köszönhetően a lelkes és nem megfelelő használat után hatástalanság és kiábrándultság következik. A melatonin a sötétség „hírvivője” a szervezetben, és szintjének változása pontosan követi a fényviszonyokat (Birchler-Pedross és mtsai, 2009; Bódizs, 2009a). A fény/sötétség váltakozásának ritmusbeállító, „zeitgeber” hatása eddigi tudásunkszerint főként a melatonin rendszeren keresztül érvényesül. Depresszióban a melatonin aktivitás növekedését (Sekula és mtsai, 1997; Szymanska és mtsai, 2001) és csökkenését egyaránt leírták (Brown és mtsai, 1985; Wetterber és mtsai, 1992), az abszolút értékek változása mellett azonban inkább a melatoninszint cirkadián ritmusának megbomlása állhat a tünetek mögött. A kezelés szempontjából tehát elsősorban a megfelelő időzítéssel végzett melatonin-receptor hatás erőteljes cirkadián ritmust szinkronizáló hatását kell megemlítenünk. A részben melatonin agonista agomelatin erőteljes kronobiotikus hatással is rendelkezik (Leproult és mtsai, 2005). A szer posztszinaptikus 5HT2C antagonizmusa, mely a frontális noradrenerg és dopaminerg hatások mellett a lassú hullámú alvás támogatása révén, az erőteljes melatonin-agonista aktivitás pedig a cirkadián ritmus reszinkronizációja révén egyszerre biztosíthatja a szer markáns antidepresszív hatását (Millan és mtsai, 2003; Quera Salva és mtsai, 2007). Számos közvetett adat utal arra a feltételezésre, miszerint az antidepresszív hatás mögött a két receptortípussal kapcsolatos mechanizmus szinergizmusa és a depresszióban megfigyelt cirkadián ritmuszavar normalizációja áll (Racagni és mtsai, 2007; Popoli, 2009). A két folyamat modell szerepe Mint láttuk, a hangulatra mind a két különböző, alvást szabályzó folyamat hat: a hangulat elég jól követi a maghőmérséklet cirkadián ritmusát: a hangulat reggel a legkevésbé jó, és a nap folyamán végig emelkedik – legalábbis a cirkadián, „C folyamat” szabályzása szerint. Ugyanakkor az alvás-ébrenlét ciklus, vagyis az „S folyamat-kapcsolt hangulat” a legjobb akkor, amikor az alvásnyomás kisebb (vagyis az ébredés után), és minél hosszabb ideig vagyunk fenn, annál rosszabb. Nagyon leegyszerűsítve tehát az S folyamat biztosítja a délelőtti, a C pedig a délutáni jó hangulatot – a hangulat tehát akkor jó, ha a cirkadián ritmus és az alvás-ébrenlét ciklus egymással egyensúlyban van. A két folyamat fáziseltolódása hirtelen hangulati ingadozásokhoz vezethet – ez szubklinikusan is igaz, de depressziós betegek esetén felerősödve jelentkezik (Boivin és mtsai, 1997). A két folyamat ritmusos stabilitása tehát elengedhetetlen a stabil euthymia fenntartásához (Wirz-Justice és mtsai, 2009; Birchler-Perdoss és mtsai, 2009). Depresszióban észlelhető fázis-előrehozatali komponensek Depresszióban számos fiziológiai paraméter 24 órás fázisa lerövidül (REM-latencia, testhőmérséklet, ébredés, kortizol-ritmus), és így az alvás-ébrenlét ritmushoz képest jelentős előretolódás jellemzi – megbomlik tehát a cirkadián ritmus és az alvás-ébrenlét ritmus fent részletezett kényes egyensúlya. Ha a napi ritmus többi elemét (főleg az elalvást) is előrehozzuk, és így szinkronba hozzuk, akkor a tünetek javulnak (Borbély és Wirz-Justice, 1982; Wehr és mtsai, 1979). Egyes, depresszióban használt gyógyszerek (egyes MAO-gátlók, ill. fázisprofilaktikumok) pedig megnyújtják a depresszióban megrövidült cirkadián ritmust (Kripke, 1983) – igaz más szerek azonban nem, sőt egyes szerek kifejezetten fázisrövidítő hatásúak (Duncan, 1996; Sprouse és mtsai, 2006). A fáziselőrehozatal további magyarázata lehet az is, hogy depressziós betegekben a szinkronizáló ingerekre („zeitgeberekre”) való reagálás képessége gyengül meg (Souetre és mtsai, 1989). Egyes vizsgálatok szerint a gyengült szinkronizáció hátterében a cirkadián ritmus belső „pacemakereiként” működő CLOCK – gének polimorfizmusai állhatnak (Bunney és Bunney, 2000; Wirz-Justice, 2006). A CLOCK – gének által mediált folyamatok további vizsgálata számos betegség – többek között a depresszió – patomechanizmusának jobb megértésében segíthet. A lassú hullámú alvás és REM-alvás arányának megbomlása Régóta ismert tény a REM-alvás arányának megnövekedése depresszióban: az első REM fázis hamarabb jelentkezik, és a REM-fázisok tovább tartanak. Korábban azt feltételezték, hogy az antidepresszívumok és a részleges alvásmegvonás is a REM szupresszión keresztül hatnak. A kettős hatású, valamint dopaminerg szereknek ugyanakkor nincs REM szupressziós hatásuk (Argyropoulos és Wilson, 2005), az alvásmegvonással végzett kezeléseknél pedig valószínűleg az időzítés, és nem a REM-megvonás vezet eredményhez. A szociális zeitgeberek és a depresszió Az emberi cirkadián ritmus egyik fontos ritmusbeállító zeitgebere a társas aktivitás. Hétköznapi tény az is, hogy a súlyos, depresszogénnek tartott tárgyvesztések (pl. a gyász) a megszokott hétköznapi aktivitás és ritmus jelentős megváltozásával járnak (Brown és mtsai, 1996). Egy hozzátartozó halála vagy válás után, vagy munkanélkülivé váláskor nemcsak elvesztünk valakit vagy valamit, hanem a veszteséggel együtt mindennapi rutin tevékenységeink is megváltoznak. Gyökeresen megváltozik a mindennapi rutin gyermek születése esetében is, különösen az azt gondozó édesanya számára. A szociális ritmusok zavara pedig fontos része a depressziós állapotnak (Ehlers és mtsai, 1993). Az is közismert a mindennapi pszichoterápiás gyakorlatból, hogy a napi aktivitás újrastrukturálása megkerülhetetlen része mind a depresszió, mind a gyász hatékony pszichoterápiájának – elképzelhető, hogy ezekb Láthatjuk tehát, hogy a cirkadián folyamatok lényeges szerepet játszanak mind a hétköznapi hangulat szabályzásában, mind az affektív zavarok patofiziológiájában. A cirkadián ritmusokat működtető endogén és környezeti folyamatok részletesebb megismerése valószínűleg segít majd a depresszió patomechanizmusának jobb megismerésében, és ezen keresztül az erre vonatkozó biológiai és pszichoszociális elméletek integrációjában is. Nyilatkozat. Az elvégzett munkáért a szerzők anyagi támogatást kaptak a Servier Hungária Kft-től. A publikáció tartalma nem szükségszerűen tükrözi a Szerkesztőbizottság álláspontját és nem jelent támogatást a márkanevek, kereskedelmi termékek vagy szervezetek nevének említése. Levelezési cím: Dr. Bódizs Róbert, MTA-BME Kognitív Tudományi Kutatócsoport, BME Kognitív Tudományi Tanszék, 1111 Budapest, Stoczek u. 2., ST. épület 304. tel.: (+3620) 822-3576 / fax: (+361) 463-1072 e-mail: rbodizs@cogsci.bme.hu web: semmelweis.hu/psychophysiology Irodalom 1. Adan A, Sánchez-Turet M (2001). Gender differences in diurnal variations of subjective activation and mood. Chronobiol Int 18(3):491–502. 2. Argyropoulos SV, Wilson SJ (2005). Sleep disturbances in depression and the effect of antidepressants. Int Rev Psychiatry 17:237–245. 3. Birchler-Pedross A, Schröder CM, Münch M, Knoblauch V, Blatter K, Schnitzler-Sack C, Wirz-Justice A, Cajochen C (2009). Subjective well-being is modulated by circadian phase, sleep pressure, age, and gender. J Biol Rhythms 24(3):232–42. 4. Benazzi F, Rihmer Z (2000). Sensitivity and specificity of DSM-IV atypical features for bipolar II disorder diagnosis. Psychiatry Res 93: 257–262. 5. Bódizs R (2000). Alvás, álom, bioritmusok. Medicina. Budapest. 6. Bódizs R (2009a). A melatonin, az alvás és a cirkadián ritmusok: elméleti megfontolások és kronofarmakológiai alkalmazásaik. Lege Artis Medicinae 19(6–7):369–74. 7. Bódizs R (2009b). Hullámok nyelvén: a szerotonin és az alvási oszcillációk. Neuropsychopharmacol Hung 11(3):191–99. 8. Boivin DB, Czeisler CA, Dijk DJ, Duffy JF, Folkard SF, Minors DF, Totterdell P, Waterhouse JM (1997). Complex interaction of the sleep-wake cycle and cirdadian phase modulates mood in healthy subjects. Arch Gen Psychiatry 54:145–52. 9. Borbély AA, Wirz-Justice A (1982). Sleep, sleep deprivation and depression. A hypothesis derived from a model of sleep regulation. Hum Neurobiol 1:205–10. 10. Brown RP, Caroff S, Kocsis JH et al (1985). Nocturnal serum melatonin in major depressive disorder before and after desmethylimipramin treatment. Psychopharmacol Bull 21:579–81. 11. Brown LF, Reynolds CF, Monk TH, Prigerson HG, Dew MA, Houck PR, Mazumdar S, Buysse DJ, Hoch CC, Kupfer DJ (1996). Social rhytm stability following late-life spousal bereavement: association with depression and sleep impairment. Psychiatry Res 62:161–9. 12. Bunney WE, Bunney BG (2000). Molecular clock genes in man and lower animals: possible associations for circadian abnormalities in depression. Neuropsychopharmacology 22:335–45. 13. Duncan WC (1996). Circadian rhytms and the pharmacology of affective illness. Pharmacol Ther 71:253–312. 14. Ehlers CL, Kupfer DJ, Frank E, Monk TH (1993). Biological rhytms and depression: the role of zeitgebers and zeitstorers. Depression 1:285–93. 15. Emens J, Lewy A, Kinzie JM, Arntz D, Rough J (2009). Circadian misalignment in major depressive disorder. Psychiatry Res 168(3):259–61. 16. Fawcet J, Scheftner WA, Fogg L, Clark DC, Young MA, Hedeker D, Gibbons R (1990). Time-related predictors of suicide in major affective disorder. Am J Psychiatry 147:1189–94. 17. Feldman-Naim S, Turner EH, Leibenluft E (1997). Diurnal variation in the direction of mood switches in patients with rapid-cycling bipolar disorder. J Clin Psychiatry 58:79–84. 18. Gaspar-Barba E, Calati R, Cruz-Fuentes CS, Ontiveros-Uribe MP, Natale V, De Ronchi D, Serretti A. (2009). Depresive symptomatology is influenced by chronotypes. J Affect Disord 119:100–6. 19. Giglio LM, Magalhăes PVS, Kapczinski NS, Walz JC, Kapczinski F (2009). Functional impact of biological rhythm disturbance in bipolar disorder. J Psychiatr Res doi: 10.1016/j.jpsychires. 2009.08.003 20. Giglio LMF, Magalhães PVS, Andersen ML, Walz JC, Jakobson L, Kapczinski F (2009). Circadian preference in bipolar disorder. Sleep Breath doi: 10.1007/s11325-009-0301-3 21. Goodwin FK, Jamison KR (2007). Manic-Depressive Illness. Bipolar disorders and recurrent depression. Oxford University Press, New York. 22. Gordijn MC, Beersma DG, Bouhusy AL, Reinink E, Van den Hoofdakker RH (1994). A longitudinal study of diurnal mood variation in depression: characteristics and significance. J Affect Disord 31:261–73. 23. Kishi T, Kitajima T, Tsunoka T, Okumura T, Ikeda M, Okochi T, Kinoshita Y, Kawashima K, Yamanouchi Y, Ozaki N, Iwata N (2009). Possible association of prokineticin 2 receptor gene (PROKR2) with mood disorders in the Japanese population. Neuromolecular Med 11(2):114–22. 24. Klisch C, Mahr S, Meissl H (2006). Circadian activity rhythms and phase-shifting of cultured neurons of the rat suprachiasmatic nucleus. Chronobiol Int 23(1-2):181–90. 25. Kripke DF (1983). Phase-advance theories for affective illness. In: Wehr TA, Goodwin FK (eds). Circadian Rhytms in Psychiatry. Pacific Grove, Calif: Boxwood Press. 26. Krueger JM, Obál F (1993). A neuronal group theory of sleep function. J Sleep Res 2(2):63–9. 27. Krueger JM, Rector DM, Roy S, Van Dongen HP, Belenky G, Panksepp J (2008). Sleep as a fundamental property of neuronal assemblies. Nat Rev Neurosci 9(12):910–9. 28. Leproult R, Van Onderbergen A, L’hermite-Baleriaux M, Van Cauter E, Copinschi G (2005). Phase-shifts of 24-h rhythms of hormonal release and body temperature following early evening administration of the melatonin agonist agomelatine in healthy older men. Clin Endocrinol 63:298–304. 29. Lewy AJ, Emens J, Jackman A, Yuhas K (2006). Circadian uses of melatonin in humans. Chronobiol Int 23(1–2):403–12. 30. Lewy AJ (2007). Melatonin and human chronobiology. Cold Spring Harb Symp Quant Biol 72:623–36. 31. Lewy AJ (2009). Circadian misalignment in mood disturbances. Curr Psychiatry Rep 11(6):459–65. 32. Li JD, Hu WP, Zhou QY (2009). Disruption of the Circadian Output Molecule Prokineticin 2 Results in Anxiolytic and Antidepressant-like Effects in Mice. Neuropsychopharmacology 34:367–73. 33. McGirr A, Renaud J, Seguin M, Alda M, Benkelfat C, Lesage A, Turecki G. (2007). An examination of DSM-IV depressive symptoms and risk of suicide completion in major depressive disorder. A psychological autopsy study. J Affect Disord 97:203–9. 34. Millan MJ, Gobert A, Lejeune F, Dekeyne A, Newman- Tancredi A, Pasteau V, Rivet JM, Cussac D (2003). The novel melatonin agonist agomelatine (S200 35. Monk TH, Buysse DJ, Reynolds III, CF, Jarrett DB, Kupfer DJ (1992). Rhythmic versus homeostatic influences on mood, activation and performance in young and old man. J Gerontol 47(4):221–7. 36. Morris DW, Rush AJ, Jain S, Fava M, Wisniewski SR, Balasubramani GK, Khan AY, Trivedi MH (2007). Diurnal mood variation in outpatients with major depressive disorder: implications for DSM-V from an analysis of the Sequenced Treatment Alternatives to Relieve Depression Study data. J Clin Psychiatry 68(9):1339–47. 37. Murray G, Allen, NB, Trinder J (2002). Mood and the circadian system: Investigation of a circadian component in positive affect. Chronobiol Int 19(6):1151–69. 38. Murray G, Allen NB, Trinder J (2003). Seasonality and circadian phase delay: Prospective evidence that winter lowering of mood is associated with a shift towards eveningness. J Affect Disord 76:15–22. 39. Murray CJL, Lopez AD (1997). Alternative projections of mortality and disabilityby cause 1990-2020: Global Burden of Disease Study. Lancet 349:1498–504. 40. Natale V, Adan A, Scapellato P (2005). Are seasonality of mood and eveningness closely associated? Psychiatry Res 136:51–60. 41. Ohayon M (2007). Insomnia: a ticking clock for depression? J Psychiatr Res 41(11):893–4. 42. Peeters F, Berkhof J, Delespaul P, Rottenberg J, Nicolson NA (2006). Diurnal mood variation in depressive disorder. Emotion 6(3):383–91. 43. Popoli M (2009). Agomelatine: innovative pharmacological approach in depression. CNS Drugs 2009;23 Suppl 2:27–34. 44. Quera Salva MA, Vanier B, Laredo J., Hartley S, Chapotot F, Moulin C, Lofaso F, Guilleminalult C (2007). Major depressive disorder, sleep EEG and agomelatin: an open label study. Int J Neuropsychopharmacol 10:691–6. 45. Racagni G, Riva M, Popoli M (2007). The interaction between the internal clock and antidepressant efficacy. Int Clin Psychopharmacol 22:S9–14. 46. Reich JW, Zautra AJ (2002). Arousal and the Relationship Between Positive and Negative Affect: An Analysis of the Data of Ito, Cacioppo, and Lang (1998). Motivation and Emotion 26(3):209–22. 47. Rihmer Z, Akiskal HS (2006). Do antidepressants t(h)reat(en) depressives? Toward a clinically judicious formulation of the antidepressant-suicidality FDA advisory in light of declining national suicide statistics from many countries. J Affect Disord 94:3–13. 48. Roenneberg T, Wirz-Justice A, Merrow M (2003). Life between clocks: daily temporal patterns of human chronotypes. J Biol Rhythms 18(1):80–90. 49. Rosenwasser AM (2009). Functional neuroanatomy of sleep and circadian rhythms. Brain Res Rev 61(2):281–306. 50. Sekula LK, Lucke JF, Heist EK, Czambel RK, Rubin RT (1997). Neuroendocrine aspects of primary endogenous depresszion. XV: Mathematical modelling of nocturnal melatonin secretion in major depressives and normal controlls. Psychiatry Res 69:143–53. 51. Selvi Y, Gulec M, Agargun MY, Besiroglu L (2007). Mood changes after sleep deprivation in morningness–eveningness chronotypes in healthy individuals. J Sleep Res 16:241–4. 52. Souetre E, Salvata E, Beluogu J, Pringuey D, Candito M, Krebs B, Ardisson JL, Darcourt G (1989). Circadian rhytms in depression and recovery: evidence for blundted amplitude as the main chronobiological abnormality. Pychiatry Res 28:263–78. 53. Sprousbe J, Braselton J, Reynolds L (2006). Fluoxetine modulates the circadian clock via phase advances via suprachiasmatical nucleus neural firing. Biol Psychiatry 60:896–9. 54. Svestka J (2008). Sleep deprivation therapy. Neuro Endocrinol Lett 29:65–92. 55. Szymanska A, Rabe-Jablonska J, Karasek M (2001). Diurnal profiles of melatonin contcentrations in patients with major depression: relationship to the clinical manifestation and antidepressant treatment. Neuro Endocrinol Lett 22:192–8. 56. Taylor DJ, Mallory LJ, Lichstein KL, Durrence HH, Riedel BW, Bush AJ (2007). Comorbidity of chronic insomnia with medical problems. Sleep 30(2):213–8. 57. Taylor DJ. Lichstein KL. Durrence HH (2003). Insomnia as a health risk factor. Behav Sleep Med 1:227–47. 58. Tolle R, Goetze U (1987). On the daily rhytm of depression symptomatology. Psychopathology 20:237–49. 59. Tonetti L, Fabbri M, Natale V (2009). Relationship between circadian typology and big five personality domains. Chronobiol Int 26:337–47. 60. Totterdell P, Reynolds S, Parkinson B, Briner RB (1994). Association of sleep with everyday mood, minor symptoms and social interaction experience. Sleep 17(5):466–75. 61. Turek FW (2007). From circadian rhythms to clock genes in depression. Int Clin Psychopharmacology 22(Suppl 2):S1–8. 62. Watson D, Wiese D, Vaidya J, Tellegen A (1999). The Two General Activation Systems of Affect: Structural Findings, Evolutionary Considerations, and Psychobiological Evidence. J Pers Soc Psychol 76(5):820–38. 63. Webb IC, Baltazar RM, Lehman MN, Coolen LM (2009). Bidirectional interactions between the circadian and reward systems: is restricted food access a unique zeitgeber? Eur J Neurosci 30:1739–48. 64. Wehr TA, Wirz-Justice A (1981). Internal coincidence model for sleep deprivation and depression. In: Koella WP, editor. Sleep 1980. Karger: Basel. 65. Wehr TA, Wirz-Justice A, Goodwin FK, Duncan WC, Gillin JC (1979). Phase advance of a circadian sleep-wake cycle as an antidepressant. Science 206:710–3. 66. Wetterberg L, Aperia B, Gorelick DA, Gwirtzman HE, McGuire MT, Serafetinides EA, Yuwiler A (1992). Age, alcoholism and depression are associated with low levels of urinary melatonin. J Psychiatry Neurosci 17:215–24. 67. Wirz-Justice A (2006). Biological rhytm disturbances in mood disorders. Int Clin Psychopharmacol 21(suppl):S11–5. 68. Wirz-Justice A, Brommundt V, Cajochen C (2009). Circadian disruption and psychiatric disorders: the importance of entrainment. Sleep Medicine Clinics 4(2):273–84. 69. Wood C, Magnello ME (1992). Diurnal changes in perceptions of energy and mood. J Roy Soc Med 85:191–4. 70. Wulff K, Porcheret K, Cussans E, Foster RG (2009). Sleep and circadian rhythm disturbances: multiple genes and multiple phenotypes. Curr Opin Gen Dev 19:237–46. |