|
A tudatállapotainkban napi gyakorisággal bekövetkező legjelentősebb módosulások az ébrenlét és az egyes alvásállapotok közötti váltakozással párhuzamosan zajlanak. Leegyszerűsítve úgy is fogalmazhatnánk: egyes alvásállapotainkban – az ébrenlét állapotához képest – naponta módosult tudatállapotokat élünk át. Feltételezve, hogy a dolgok eredetének tisztázása nagymértékben elősegíti azok lényegének megértését, az alábbiakban ezeknek a tudatállapotoknak a mibenlétét a törzsfejlődés tükrében igyekszünk megfejteni.
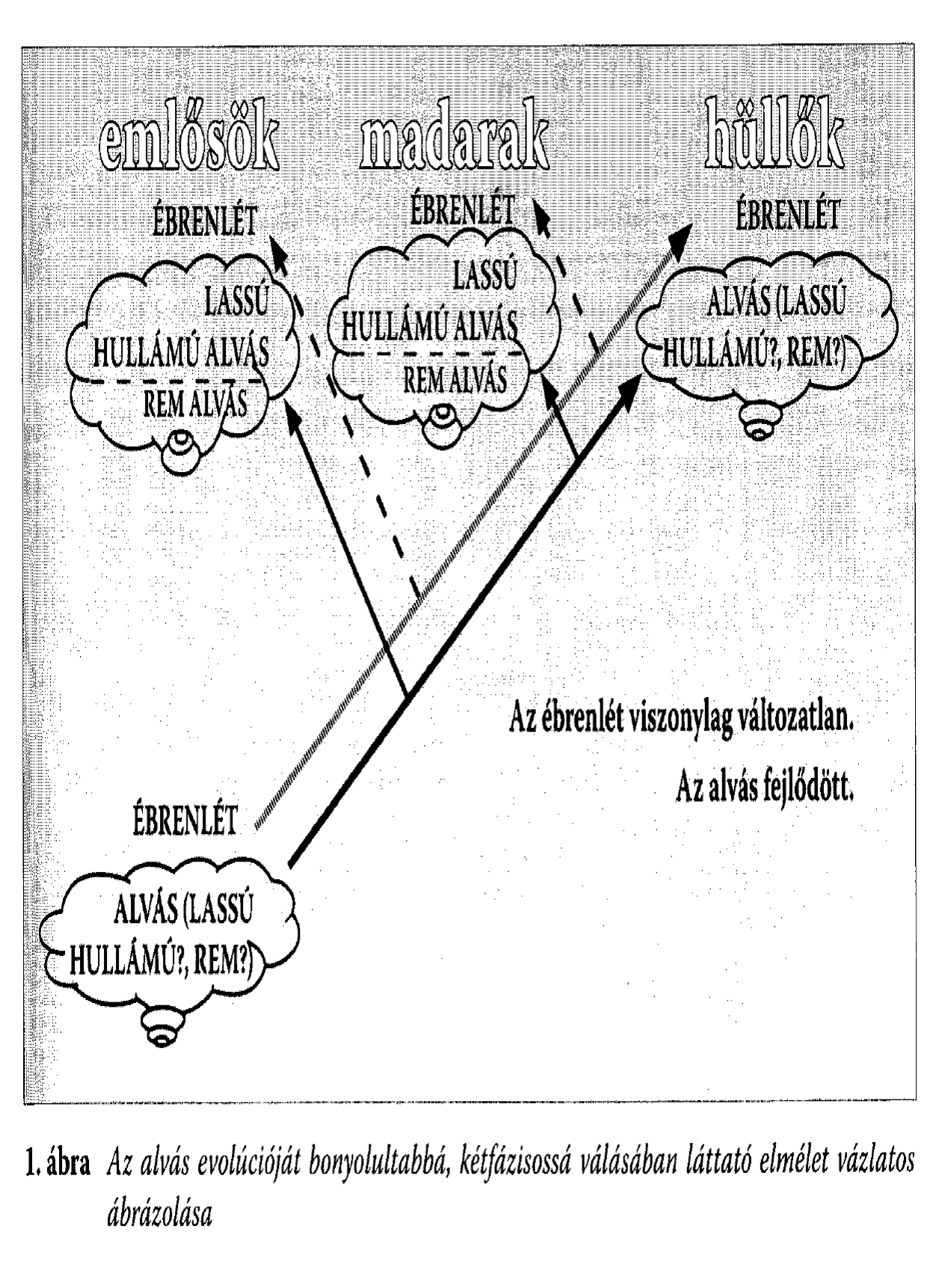
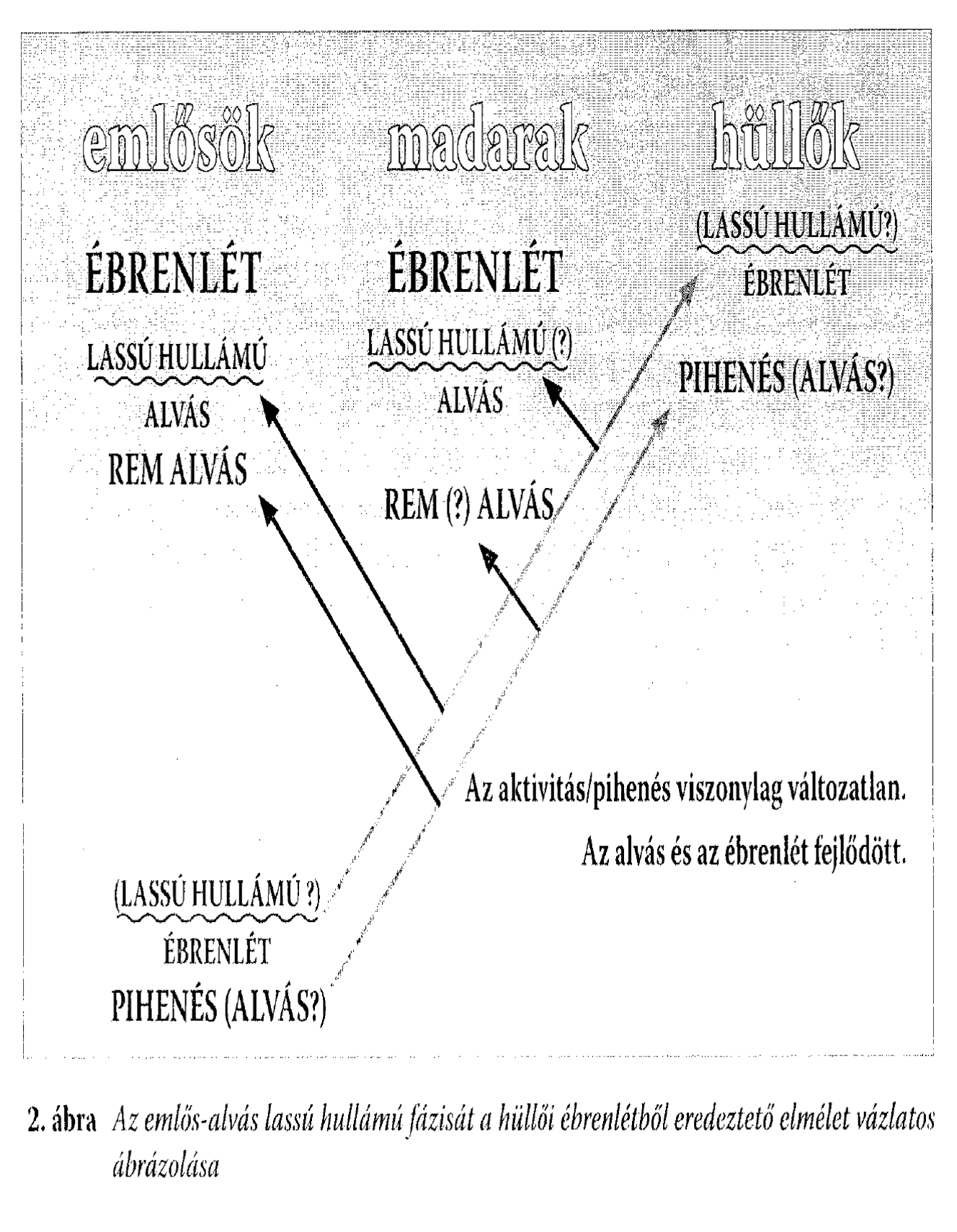
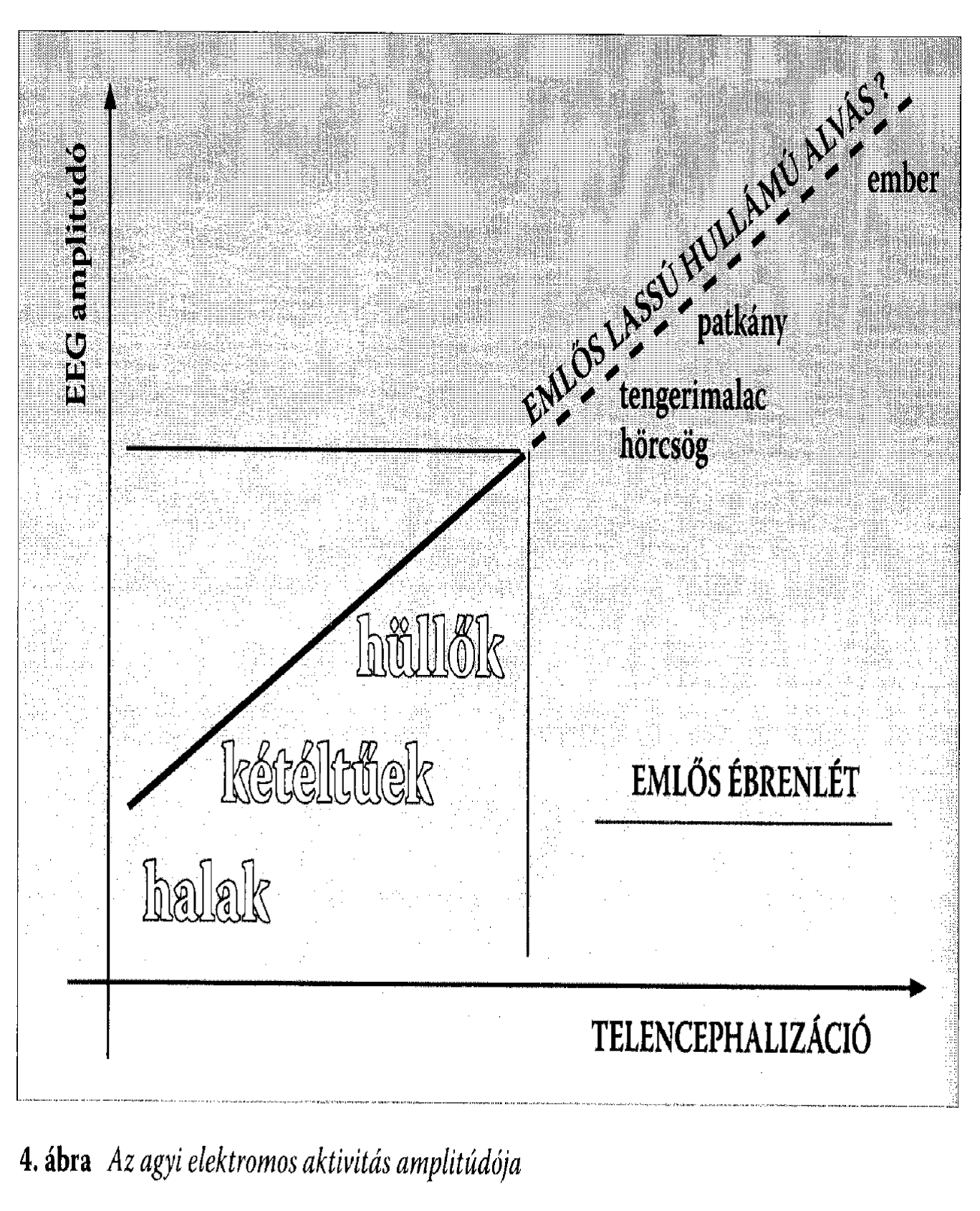
7.1 Az ember (Homo sapiens) alvásállapotaiMás emlősökhöz hasonlóan az ember alvása két elektrofiziológiailag elkülöníthető állapotra, a non-REM (más néven lassú hullámú) és REM alvásra (a rapid eye movements, azaz gyors szemmozgások rövidítéséből), osztható. Az ébrenlétet alacsony amplitúdójú és magas frekvenciájú agyi elektromos tevékenység jellemzi, ami jelentősen eltér a lassú hullámú alvásra jellemző, 12-15 Hz-es hullámcsomagokban jelentkező alvási orsózástól és nagy amplitúdójú, alacsony frekvenciájú agyi elektromos tevékenységtől (lassú hullámoktól). A REM alvást a viselkedéses inaktivitás ellenére az ébrenléthez hasonló alacsony amplitúdójú és magas frekvenciájú agyi elektromos tevékenység jellemezi. Utóbbihoz általában gyors szemmozgások és a vázizmok erőteljes tónuscsökkenése vagy tónusvesztése társul (Aserinsky és Kleitman 1953; Rechtschaffen és Kales 1968). A tudatállapotoknak egyfajta belső, a környezettől független és az ideg-ingerületátvivő anyagok által meghatározott dinamikájuk van. Ha ezt fenomenológiailag az érzékszervi benyomások, a gondolkodás (mentális tevékenység) és a mozgás tekintetében jellemezzük, akkor az ébrenlétet az élénk, külsőleg generált érzékszervi élmények, a logikus progresszív gondolkodásra irányuló tendencia vagy annak képessége és az akaratlagosan vezérelt mozgás jellemzik. Lassú hullámú alvásban tompa vagy hiányzó érzékszervi élmények, némileg megtartott racionalitással jellemezhető, de gyakran ismétlődő tartalmú gondolat, illetve emléksorok, valamint ritka, akaratlan, mondhatni epizodikus mozgások együttállásával írható le az alvó tudatállapota. A REM alvás viszont élénk, belsőleg generált érzékszervi élményekkel, illogikus, bizarr gondolatsorokkal és a kivitelezést nélkülöző élénk mozgásélményekkel jellemezhető (Hobson és Pace-Schott 2002). E három tudatállapot neurokémiai hátterét az aminerg (noradrenerg és szerotoninerg), illetve kolinerg ingerületátvitel és/vagy neuromoduláció tekintve is jelentősen eltér. Ébrenlét állapotában mindkét rendszer aktív, lassú hullámú alvásban mindkét rendszer aktivitása alábbhagy, míg REM alvásban a kolinerg rendszer erőteljes aktivitását hiányzó aminerg moduláció kíséri. Az agyi neuromodulációra vonatkozó ismeretek fényében terjedt el az a nézet, miszerint az aminerg-kolinerg egyensúly, mint neurokémiai háttér a tudatállapotok fent említett jellemzőiből is sokat megmagyaráz (Hobson 1988; Hobson és Pace-Schott 2002). 7.2 Az ébrenlét kérdéseMivel az emlősökéhez hasonló kétféle alvásra vonatkozó (lassú hullámú és REM) bizonyítékokat hüllőknél, kétéltűeknél és halaknál nem találtak, az alvás törzsfejlődésére vonatkozó elképzelésekben az alvás dualizmusát egyértelműen egy evolúciós vívmányként (egyfajta fejlettebb alvásként) írták le (1. ábra), ami a homeotermiával (állandó testhőmérséklettel) egy időben az emlősöknél és a madaraknál jelent meg az élővilágban. Ez a nézet különböző érvekkel alátámasztva és különböző formákban tartja magát a szakirodalomban (Kavanau 1997; Jouvet 2001). A vélemények egyöntetűségét részben a hüllők agyi elektromos aktivitásmintázatainak korai vizsgálata magyarázza, amelynek során néhány, a hüllők agyának elektromos tevékenységével, illetve annak rögzítésével kapcsolatos módszertani kérdést nem tisztáztak. Ilyenek pl. az agyi elektromos tevékenység hőmérsékletfüggése, a kisméretű agy miatti nehéz regisztrálhatóság problémájának elnagyolt megoldásai, stb. (Nicolau és mtsai 2000). Természetesen nem tudhatjuk biztosan, hogy a mai hüllők, madarak és emlősök közös őseinek (Ichtiostega) milyen alvása lehetett, mégis az idézett elképzelések kimondatlan formában azt a feltételezést is tartalmazzák, hogy az evolúció során az alvás fejlődött, bonyolultabb lett (kétfázisossá alakult át), miközben a túlélést jelentő magatartáselemek közös háttérállapota, az ébrenlét viszonylag változatlan maradt, vagy legalábbis az alvástól függetlenül módosult. Ez a megközelítés jól tükrözi az alvás REM szakaszának vélt vagy valós misztériuma által mozgósított kutatói kezdeményezések szűklátókörűségét, az alvás fejlődésének központi kérdéssé emelését, valamint az ébrenlét problematikájának háttérbe szorulását. Lehetséges volna, hogy egy teknősbéka és egy csimpánz inkább alvásuk, mint ébrenlétük tekintetében különbözzenek egymástól? A választ mindenki eldöntheti magában, mielőtt tovább olvasna. A fenti nézetekkel szemben létezik azonban egy másik, újabb keletű elképzelés is, amely az alvás evolúcióját az ébrenlét kérdésével és az agy törzsfejlődésével összefüggésben veti föl. Eszerint a fejlett előaggyal rendelkező emlősök ébrenléte egy új létállapot, aminek nincs megfelelője az agytörzsi viselkedésvezérléssel jellemezhető halak, kétéltűek és hüllők körében. Miközben ez az agykérgi vezérlésű új állapot átvette a vezető szerepet a túlélést jelentő viselkedésformák koordinálásában, az agytörzsi viselkedésvezérléssel jellemezhető korábbi aktivitás és pihenés az emlősöknél egyaránt az inaktivitás periódusaira korlátozódva lassú hullámú és REM alvássá alakult (Nicolau és mtsai 2000; Gamundí és mtsai 2003). E szerint az elképzelés szerint a törzsfejlődés során az ébrenlét és az alvás egymással kölcsönös összefüggésben fejlődött, változott, míg az aktivitás és pihenés dualizmusa állandónak bizonyult (Gamundí és mtsai 2005). Ami ma alvás formáját öltő állapot az korábban aktivitás vagy primitívebb ébrenléti állapot lehetett (2. ábra). Ezen gondolatmenet keretében, az empirikus bizonyítékok áttekintése és új adatok gyűjtése révén megkérdőjeleződött a madarak alvásának dualizmusáról szóló eddigi tézis is (Garau és mtsai 2005a, b). Az alábbiakban áttekintjük az ébrenlét és alvásállapotok törzsfejlődésének Nicolau és mtsai (2000) által felépített elméletét, miközben az eredeti okfejtést új bizonyítékokkal és a tudatállapotokra vonatkozó következmények kidomborításával egészítjük ki. 7.3 Az ébrenlét funkcionális neuroanatómiája embernélAz elmélet egyik sarokköv e, hogy az emlősök ébrenléte a törzsfejlődésben új, az előagy fejlettsége révén előálló állapot, ami nem rokonítható a hüllők, kétéltűek és halak viselkedésesen aktív periódusaihoz. A klasszikus nézet szerint, jóllehet kimondatlanul, az emlős-ébrenlét a korábbi gerincesek ébrenlétének származéka. Az ember esetében az ébrenlét, mint tudatállapot jellegzetes minőséggel bír, és mint ilyen élményszinten is különbözik az alvástól, az általános anesztéziától és a kómától. Az emberi agy ébrenlét alatti tevékenységének összehasonlítása a fentebb felsorolt módosult tudatállapotokat jellemző agyműködéssel, tanulságos eredményekkel szolgál az ébrenlét alatti tudatállapot funkcionális agyi jellegzetességeit tekintve. Az összehasonlításokban közös eredmény a fokozott hátulsó fali lebenyi aktivitás (helyi véráramlás vagy glükóz-felhasználás) éber tudatosságra specifikus mivolta (Gusnard és Raichle 2001). Az ébrenlét alatti tudatállapot funkcionális agyi jellemzőinek legstabilabb és legmegbízhatóbb összetevője anatómiailag egy olyan struktúrához köthető, amely filogenetikailag új, és mint ilyen az emlősagy jellegzetes összetevője. Vajon mit mondhatunk azon fajok egyedeinek ébrenléti állapotáról, amely fajok nélkülözik a hátsó fali lebenyt, mint agyanatómiailag új és filogenetikailag modern struktúrát? Vajon a mi fogalmaink szerint lehet-e egyáltalán ébren egy gyík? A kérdés megválaszolásához segítségül hívhatjuk az elektrofiziológiát és a farmakológiát. 7.4 Elektrofiziológiai megfontolások-I: lassú hullámok és orsókA Kanári-szigeteki gyíkok (Gallotia galloti) agyában a korábban említett módszertani problémák meghaladásával regisztrált elektromos aktivitásmintázatok meglepő hasonlóságot mutattak az emlősök lassú hullámú alvására jellemző agyi elektromos aktivitásmintázatokkal. Bár ez a hasonlóság a számszerűsítés hiányában is nyilvánvaló, hiszen nagy amplitúdójú lassú hullámok és orsózó aktivitásmintázatok mérhetőek a gyíkok viselkedéses aktivitása közben (De Vera és mtsai 1994), a felvett jelek spektrális elemzése és nem-lineáris jellegzetességei szintén megerősítik az állapotok elektrofiziológiai rokonságát (González és mtsai 1999). Mivel emlősök esetében a skalp vagy a kéreg fölött mért alvásfüggő lassú hullámok kialakulásában az előagynak meghatározó szerepe van (Amzica és Steriade 1998, Dang-Vu és mtsai 2005), az igen kisméretű előaggyal rendelkező hüllőktől (Zboray 2001) sokan eleve elvitatják a lassú hullámok generálásának képességét (Rattenborg 2006). Csakhogy közben meggyőző bizonyítékok láttak napvilágot arra vonatkozóan, hogy az emlősök agyában az alvásfüggő lassú hullámok korántsem a kéreg kizárólagos sajátosságai. Macskák (Felis catus) és emberek lassú hullámú alvásában számos kéreg alatti területen (amygdala, hypotalamus, nucleus centralis lateralis thalami, spetum, nucleus caudatus, substantia nigra) és egy olyan ősi kéregrészben is, mint a hippokampusz alacsonyfrekvenciájú, nagyfeszültségű hullámtevékenység uralkodik, amely a kérgi eredetű lassú hullámokhoz hasonlóan alvásmegvonás utáni alvásban fokozott (Lancel és mtsai 1992; Lancel 1993). Vagyis a lassú hullámok nem tekinthetőek a kéreg illetve az előagy kizárólagos és alvásspecifikus funkcionális sajátosságának. A hüllőkben mért lassú hullámok jellegzetessége a hullámamplitúdó és a hőmérséklet közötti egyenes irányú kapcsolat: minél nagyobb a külső hőmérséklet (amit hőszabályozás hiányában a hüllők szervezete is átvesz), annál nagyobb az agyi lassú hullámok amplitúdója (De Vera és mtsai 1994). Bár a szerzők nem utalnak rá, ez az összefüggés szintén az emlősök lassú hullámú alvásához hasonló. Ismert tény, hogy a szervezet maghőmérsékletének emelkedése immunfolyamatok révén vagy akár passzív melegítéssel az alvás alatti lassú hullámú agyi elektromos aktivitás fokozódását vonja maga után a legkülönbözőbb emlősöknél az embert is beleértve (Carlson 1991; Gao és mtsai 1995). Ami a gyíkok viselkedésesen aktív periódusaiban rögzített orsózó hullámformákat illeti, azoknak pedig a frekvenciája áll egyenes arányban a hőmérséklettel (De Vera és mtsai 1994). A szerzőket kiegészítve itt is megemlíthetjük az ember alvási orsóinak frekvenciájában mutatkozó hőmérsékletfüggést, amit a menstruációs ciklussal összefüggő testhőmérséklet-ingadozások kapcsán mutattak ki (Driver és mtsai 1996). A lassú hullámokhoz hasonlóan fiziológiás orsók emlősök kéreg alatti vagy ősi kérgi struktúráiban – elsősorban a talamuszban – illetve a limbikus rendszeri struktúrák közül a hippokampuszban is megfigyelhetőek (Contreras és mtsai 1997; Malow és mtsai 1999). Az agy elektromos háttértevékenységének tekintetében tehát a hüllők inkább egy lassú hullámú ébrenlétben, mint egy az emlősök körében egyetemesen elterjedtnek mondható magasfrekvenciájú elemekkel jellemezhető ébrenlétben töltik viselkedésesen aktív periódusaikat. Az ingerekre való reagálás módját tekintve szintén alapvető különbség figyelhető meg a hüllők és az emlősök viselkedéses aktivitását jellemző agyi elektromos tevékenységmintázatokban. Az emlősök agyában a lassú hullámú alvásból való ébredésekor/ébresztésekor az elektromos aktivitás amplitúdója csökken, frekvenciája pedig nő (Kleinlogel 1983). Ugyanez figyelhető meg akkor is, amikor az éber nyugalmi periódusban embernél a 8-12 Hz-es szinkronizált alfa aktivitást egy inger (pl. világosban szemnyitás általi fényhatás) gátolja és helyette kisebb amplitúdójú, nagyobb frekvenciájú tevékenységet mozgósít (Hughes és Crunelli 2005). A Kanári-szigeteki gyíkok ketrece fölött a fényingerlés bekapcsolása az agyi elektromos aktivitásuk jelentős amplitúdó növekedését és frekvenciacsökkenését idézte elő, azaz lassú hullámokat váltott ki (Nicolau és mtsai 2000). Hasonló megfigyeléseket tettek a hüllők agyi elektromos aktivitásának amplitúdóját a viselkedés függvényében vizsgáló kutatók: általánosnak mondható az a megfigyelés miszerint a viselkedéses aktivitás fokozza az amplitúdót, ami igen jelentős eltérés az emlősökhöz képest (Nicolau és mtsai 2000; De Vera és mtsai 2005). Ez a reagálási mód – vagyis az aktiváció amplitúdót fokozó és lassú komponenseket kiváltó hatása – az emlősök lassú hullámú alvására és nem az ébrenlétére jellemző (3. ábra). Reaktív, nagyfeszültségű lassú hullámok például igen gyakran megfigyelhetőek az emlősök, közöttük az ember lassú hullámú alvása során, amikor az ingerlés által mozgósított aktiváció (átmeneti izomtónus- és szívritmusfokozódás) amplitúdónövekedést von maga után az agyi elektromos aktivitásmintázatokban (Halász és mtsai 2004). 7.5 Elektrofiziológiai megfontolások-II: ébrenlét, alvás, meredek hullámokA hüllők viselkedéses aktivitása közben regisztrált és az emlősök lassú hullámú alvását jellemző agyi elektromos tevékenységmintázatok más tekintetben is meglepően hasonlítanak egymáshoz. A felvillanó fényingerek vagy taktilis ingerek Kanári-szigeteki gyíkok illetve gekkók (Gekko gecko) agyi aktivitásában nagy amplitúdójú meredek hullámokat és egyes esetekben azt követő orsózó aktivitásmintázatokat váltanak ki (De Vera és mtsai, 1994; Gaztelu és mtsai, 1991), amelyek az emberi lassú hullámú alvás kezdeti szakaszában látható vertex meredek hullámokhoz, máskor a K-komplexusokhoz hasonlóak (Nicolau és mtsai, 2000). Fontos hangsúlyozni, hogy az emlősök ébrenlét alatti agyi elektromos aktivitásában a külső ingerek által előidézett változások szabad szemmel általában nem láthatóak, ezek ugyanis csak több ingerre adott válasz átlagolásából – a kiváltott válaszok vizsgálatának alapvető módszerével – nyerhetőek ki (Dawson, 1954). Úgy tűnik tehát, hogy a hüllőknél tapasztalt szabad szemmel látható kiváltott válaszoknak nincsenek megfelelőik az emlősöknél, illetve az embernél. Mindez azonban csak az ember (és feltehetően más emlősök) ébrenléti állapotára érvényes. Lassú hullámú alvásban ugyanis az akusztikus ingerek hatására gyakran nagyfeszültségű hullámok generálódnak, amelyek többnyire a K-komplexusok különböző formáit öltik és szabad szemmel is jól megfigyelhetőek. A kiváltott válaszok és a kiváltott K-komplexusok közötti összefüggések vizsgálatának fő tanulsága, hogy a K-komplexus egyfajta tudatelőttes információfeldolgozási folyamat jele, amelynek során a kiváltó inger és kontextusa függvényében mérlegelhetővé válik az alvás folytatása vagy annak megszakítása (Halász, 1993) és (tegyük hozzá) utóbbi esetben értelemszerűen a megfelelő viselkedéses válasz mozgósítása. Amennyiben ez a hüllők kiváltott válaszaival kapcsolatban is érvényes, úgy elmondható, hogy kiváltott válaszaik első, nagyfeszültségű komponense az ingerekre való válaszadás vagy a „válaszra sem méltatás” lehetőségei közötti döntésként fogható föl. A hüllők agyi elektromos tevékenységének vizsgálatában központi helyet foglal el a spontán megjelenő meredek hullámok kérdése. Ennek legfőbb oka, hogy a meredek hullámok más agyi elektromos aktivitásmintázatoknál határozottabban kirajzolódnak. Másik oka talán az, hogy a meredek hullámokban a legtöbb kutató az emlősökben regisztrálható hippokampális meredek hullámok (Buzsáki, 1986) megfelelőit – ezen keresztül pedig a lassú hullámú alvás markereit – látja. Ennek megfelel az a megfigyelés, miszerint a meredek hullámok hüllők viselkedésesen inaktív periódusaiban jelennek meg legnagyobb valószínűséggel, valamint az is hogy a fizosztigmin általi kolinerg stimuláció csökkenti a gyakoriságukat (Gaztelu és mtsai, 1991; Velluti és mtsai, 1991). A hüllők alvása és a meredek hullámok közötti kapcsolat azonban több szempontból is ingatag és semmiképpen sem tekinthető meggyőzőnek. Az eredeti beszámolók olyan megfigyelései, mint például a szenzoros stimuláció hatására fokozódó meredekhullám-gyakoriság (lásd a fentebb említett kísérleti eredményeket is) nehezen illeszthetőek abba az elképzelésbe, hogy a meredek hullám egyértelműen az alvás jele. Másrészt a hippokampális meredek hullámok nem csak az emlősök alvásának idején, hanem éber nyugalmi periódusaikban is megjelennek (Buzsáki, 1986). Ugyanakkor emlősöknél nem csak lassú hullámú alvásban, hanem REM alvásban is mérhetőek meredek hullámok, utóbbiakat ponto-genikulo-okcipitális (PGO) tüskéknek nevezzük, amik a hídban erednek, innen viszont – patkányokon (Rattus norvegicus) végzett kutatások tanulságai szerint – a talamuszon keresztül a kérgi és a hippokampális régiókba is átterjednek (Datta és mtsai, 1998). Ráadásul emlősökben a PGO aktivitás külső ingerekkel is kiváltható vagy fokozható (García-García és Drucker-Colín, 1999), ami még inkább hasonlatossá teszi őket a hüllőknél ingerlés hatására megjelenő meredek hullámokhoz. A hüllők agyában regisztrált meredek hullámok tehát a PGO aktivitás megfelelői is lehetnek (Nicolau és mtsai, 2000). Mivel egyes hüllőknél a viselkedéses inaktivitás periódusaiban szemmozgásokat is regisztráltak a felsorakoztatott bizonyítékokat figyelembe véve a keresett hüllői alvásfázis akár REM is lehetne. Az eddigieket összesítve megállapítható, hogy a körültekintően végzett vizsgálatok egyes hüllőfajok egyedeinek jellegzetes agyi elektromos aktivitásmintázatait az emlősök lassú hullámú alvásában tapasztalható aktivitásmintázatokhoz találta hasonlatosnak. Mindez tehát arra is utalhat, hogy a lassú hullámú alvás korábban ébrenléti állapot volt. Ha ezt további bizonyítékok is alátámasztják, ennek sajátosságai a hüllői lét sajátosságaihoz lehetnek hasonlatosak, vagyis a hüllői viselkedésszervezésből következtetéseket vonhatunk le az ember egyik tudatállapotára vonatkozóan. 7.6 Neurofarmakológiai megfontolások: a hiányzó ébrenlétAz emlősök lassú hullámú alvása és a hüllők aktív periódusai közötti hasonlóságot egyes farmakológiai adatok is megerősítik. Az agyi lassú hullámok amplitúdója jelentősen csökken a béta-antagonista propranolol hatására gyíkokban (De Vera és mtsai, 2000). Hasonló jelenség figyelhető meg emlősök alvása alatt, mivel a propranolol csökkenti a lassú hullámokkal jellemezhető alvásszakaszok részarányát (Hilakivi és mtsai, 1978). Másrészt viszont, az emlősök ébrenlétének egyedülállósága – mint tézis a kolinerg rendszer befolyásolása révén nyer alátámasztást. A muszkarin antagonista atropin jelentősen fokozza a lassú hullámú agyi elektromos aktivitást éber állatokban és az emberi atropinmérgezés klinikai eseteiben (Dringenberg és Vanderwolf, 1998), de semmilyen befolyással nem rendelkezik a már említett kanári szigeteki gyíkok amúgy is lassú hullámok által dominált agyi elektromos aktivitásának spektrális összetevőire (De Vera és mtsai, 2000). Ez talán összefügghet azzal a megfigyeléssel, amely szerint – legalábbis az eddig vizsgált hüllők dorzális kortexének sejttestei között nem találtak acetilkolint termelő neuronokat, amelyek emlősökben a kérgi kolinerg interneuronoknak felelnének meg (Reiner, 1991). 7.7 Alvajárás: lassú hullámú ébrenlét embernél?A fenti eredményeket összefoglalva úgy tűnik, hogy az emlős-ébrenlét nem hasonlítható a hüllők viselkedéses aktivitással jellemezhető periódusaihoz, mivel utóbbiak leginkább az emlősök lassú hullámú alvására jellemző elektrofiziológiai és neurokémiai sajátosságokat mutatnak. Azt is mondhatnánk, hogy a hüllők – és minden bizonnyal a kétéltűek és a halak is – egyfajta lassú hullámú ébrenlétben valósítják meg a környezetükhöz való viselkedéses alkalmazkodást. Ehhez hasonló jelenséget embernél csak a lassú hullámú alvást jellemző egyes paraszomniák klinikai manifesztációi során figyelhetünk meg. Ennek paradigmatikus esete az alvajárás, amelynek során a viselkedéses aktivitás és a környezethez való bizonyos fokú alkalmazkodás (pl. akadályok kikerülése) közben elektrofiziológiai módszerekkel nagy amplitúdójú lassú hullámok regisztrálhatóak az a skalp fölött (Broughton, 1968). Jelenleg az alvajárást disszociált állapotnak, vagyis az ébrenlét és a lassú hullámú alvás keveredésének tekintik (Mahowald és Schenck, 2005). Ugyanakkor látnunk kell, hogy ez egy ősi, lassú hullámú ébrenlétnek is tekinthető, hiszen sajátosságai fellelhetőek más gerincesekben is. Utóbbi gerincesek azonban, igen kisméretű előaggyal rendelkeznek és viselkedésük vezérlésében is inkább agytörzsi struktúráik játsszák a központi szerepet. Tanulságos e tekintetben egy esettanulmány, amely egy 16 éves fiú alvajárás alatt rögzített regionális agyi véráramlásmintázatról számol be, fotonemissziós tomográfián és azzal egyidejűleg kivitelezett video-EEG monitorozáson alapuló módszerrel (Bassetti és mtsai, 2000). Alvajárás idején, a zavartalan alváshoz képest 25%-al fokozódott az elülső kisagyi régió (vermis) és a hátulsó cinguláris kéreg helyi véráramlása. Ezzel szemben az ébrenléthez viszonyítva a homlok és a fali lebenyi véráramlás igen alacsony szinten maradt. Tudvalévő, hogy a vermis a kisagy egyik legősibb anatómiai régi ója (Zboray, 2001) és a cinguláris kéreg is a limbikus rendszer része. Ugyanakkor az ébrenlét alatti viselkedésvezérléssel illetve magával az ébrenlét állapotával összefüggésbe hozható homlok- és fali lebenyi területek (Gusnard és Raichle, 2001; Maquet, 2000) az epizód alatt nem „ébredtek föl”. Mindezt a video- EEG regisztrátum tanúsága szerint viselkedéses aktivitás és lassú agyi elektromos tevékenység jellemezte. Vagyis itt a korábban elemzett lassú hullámú ébrenlét minősített esetét érték tetten embernél, amelynek során ráadásul olyan ősi agyi struktúrák vonódtak be az aktivációba, amelyek egyébként hagyományosan nem tekinthetőek a mozgással kapcsolatos elsőrendű központi idegrendszeri elemeknek – embernél. 7.8 Hullámamplitúdó és telenkefalizációAz agyi elektromos tevékenység amplitúdója nő a halak-kétéltűek-hüllők osztályainak sorozatában (Bullock és Başar, 1988). Az összehasonlító neuroanatómiai összefüggések ebben a sorozatban elsősorban a telenkefalon és a talamusz fejlődésében látnak különbséget. A hüllők előagya és talamusza viszonylag nagyobb kiterjedésű, mint a két másik osztályé, a kétéltűeké pedig köztes helyet foglal el (Zboray, 2001). Lehetséges, hogy az agyi elektromos tevékenység amplitúdója az előagy és az azzal szorosan kapcsolódó talamusz fejlettségének egyik mutatója? Az emlősöknél ez az összefüggés megtörik, ha az ébrenlétre alapozzuk a mérést. Az emlősök ébrenlét alatt regisztrált agyi elektromos tevékenységmintázatai kifejezetten alacsony amplitúdójúak és nem különböznek jellegzetesen a rendek között. Ez szintén jelentheti azt, hogy az emlős ébrenlét egy filogenetikai értelemben új állapot. Azonban a lassú hullámú alvást jellemző agyi elektromos tevékenység amplitúdóját tekintve van némi bizonyíték a fenti összefüggésre, azaz annak alátámasztására, hogy az előagyi fejlettség egyik mutatója emlősöknél is az amplitúdó, de a lassú hullámú alvás alatti amplitúdó. A fajok közötti összehasonlításokkal kapcsolatban rendelkezésre álló adatok azt mutatják, hogy az ember agykérgi elektromos tevékenységének amplitúdója nő a legnagyobb mértékben az ébrenlétből a lassú hullámú alvásba való átmenet során. Ugyanezt a mutatót figyelembe véve a laboratóriumi vizsgálatok alanyait képező rágcsálók összehasonlításában a patkány a tengeri malac (Cavia porcellus) és a hörcsög (Mesocricetus auratus) elé kerül (Kleinlogel, 1983). Az ember előnyét a telenkefalizáció szempontjából nem kell külön bizonygatni. A patkánynak a tengeri malaccal és a hörcsöggel szembeni előnyét viszont életmódja is mutatja, hiszen meggyőző adatok támogatják a fajspecifikus viselkedésrepertoár mérete és az enkefalizáció szoros pozitív korrelációját (Changizi 2003). Ugyanakkor a patkányok tanulékonysága és viselkedéses flexibilitása a laboratóriumi vizsgálatok és az emberével vetekvő kozmopolita jellegének fényében egyértelműen kiviláglik, a sokkal specializáltabb és csak sajátos életterekben alkalmazkodni képes más rágcsálókéhoz képest (4. ábra). Úgy tűnik továbbá, hogy az agykérgi fejlettség lokális különbségei is kirajzolódnak a lassú hullámú alvást jellemző neurális oszcillációkból. Ismert tény, hogy embernél az alvásfüggő lassú hullámok a homloklebenyek fölött a legkifejezettebbek, az ember homloklebenyeinek rendkívüli fejlettsége pedig szintén közismert (Horne 1993). Másrészt a fali lebeny asszociációs területei szintén humánspecifikusan fejlettek. Megközelítésünkben ez elektrofiziológiailag az alvási orsózás homlok- és fali lebenyi maximumának (Ishii és mtsai, 2003, De Gennaro és mtsai 2000) felelhet meg. Végül a kérgi területek egyéni fejlettsége és az alvásfüggő neurális oszcillációk kapcsolatára is van némi közvetett bizonyíték. A pszichológiai tesztekkel mért intelligenciahányados egyenes összefüggésben áll a homloklebeny kéregállományának térfogatával (Gray és Thompson 2004), saját vizsgálataink szerint pedig a homloklebeny fölött mért alvásfüggő neurális oszcillációk egyéni mértékével (Bódizs és mtsai 2005a). Másrészt viszont a vizuális memóriateljesítmények egyéni szintje a jobb féltekei kéregállomány térfogatával korrelált (Fjell és mtsai 2005), amit saját eredményeink közül a vizuális memória és a jobb fali lebeny fölötti alvási orsózás összefüggésének (Bódizs és mtsai 2005b) feleltethetünk meg. Mindez arra utal, hogy a lassú hullámú alvás neurális oszcillációi tükrözik az előagy illetve a kéreg fejlettségét, ami a nem-emlős gerincesekben a hullámamplitúdók aktív periódusokban mért fajspecifikus különbségeiben fejeződik ki. Vagyis az előagyi fejlettség és az oszcillációk összefüggése emlősöknél, a halakkal, kétéltűekkel és hüllőkkel szemben a lassú hullámú alvásra korlátozódott. A lassú hullámú agyi elektromos aktivitás amplitúdója és az előagyi fejlettség közötti összefüggést nemrég a hüllők – madarak – emlősök összehasonlításában egy olyan kutató is fölvetette, aki a klasszikus nézet és módszertani háttér alapján elvitatja a hüllőktől a lassú hullámú aktivitás generálásának képességét (Rattenborg 2006). Az elmélet madarak és az emlősök alvásfüggő lassú hullámú agyi elektromos aktivitását a pallio-palliális neurális kapcsolatok fejlettségével magyarázza. A hüllők e téren mutatkozó hátránya kétségkívül befolyással lehet lassú hullámaik amplitúdójára, azonban vannak bizonyítékok a lassú hullámok kéregalatti struktúrákban való kialakulására (Lancel és mtsai 1992; Lancel 1993), akárcsak a hüllők lassú hullámú agyi elektromos aktivitására is (De Vera és mtsai 1994; González és mtsai 1999; Nicolau és mtsa, 2000). Igaz utóbbi amplitúdóban többnyire elmarad a fejlett előaggyal (és Rattenborg nyomán hozzátehetjük: fejlett pallio-palliális kapcsolatokkal) rendelkező osztályok alacsonyfrekvenciájú elektromos aktivitásmintázatainak amplitúdójától. 7.9 Az alvás mint válogatás: poikiloterm tudat?Vajon a fejletlen előaggyal rendelkező, poikiloterm osztályok (halak, kétéltűek, hüllők) viselkedésszervezése illetve viselkedés-élettana alapján milyen következtetéseket vonhatunk le az ember alvás alatti tudatállapotáról? Levonhatunk-e valamilyet egyáltalán? Az ember és az emlősök viselkedését leginkább előagyi folyamatok határozzák meg. Ébrenlét állapotában, természetesen. Mi a szerepe a halak, a kétéltűek és a hüllők előagyának? Lehetséges volna, hogy ennek a kérdésnek a megválaszolása közelebb visz bennünket a lassú hullámú alvás állapotának megértéséhez? Az összehasonlító neuroanatómusok vonatkozó tankönyvi idézetei a következőképpen szólnak: „A telencephalon halak esetében aktiváló (facilitáló) rendszer, az öröklött és szerzett cselekvésformákat stimulálja.” „A telencephalonban dől el az, hogy a szervezetet ért többi ingerülettel együtt az optimális válaszreakció kialakulásához mely információkat kell előnyben részesíteni, ill. tovább vezetni vagy éppen gátolni.” (Zboray, 2001, kiemelések: B.R. és Cs.Sz.) Másrészt a hüllők viselkedésszervezésével és feltételezett kognitív aktivitásukkal kapcsolatban az alábbi, számunkra jelentőséggel bíró összegzés fogalmazódott meg: A tipikus hüllői tudat nem tud környezetének egynél több jellemzőjére reagálni, vagyis az emlősökre jellemző polimodális reprezentációk valószínűleg hiányoznak (Sjölander 1995). A fenti megfogalmazások értelmében az előagy szinteti záló, összegző, integráló feldolgozó funkciója ezekben az osztályokban nem alakult ki. Ehelyett a szenzoros bemenetek és mozgásmintázatok közötti válogató funkció érvényesül. Vajon elmondható-e ugyanez vagy ehhez hasonló az emlősök, köztük az ember lassú hullámú alvásával kapcsolatban? A környezettel való kapcsolat, illetve a személy környezetére irányuló tudatosság mindkét alvásállapotban jelentősen háttérbe szorul, de nem szűnik meg teljes mértékben. Az alvás egyik legfontosabb tulajdonsága az ébreszthetőség. A hétköznapi megfigyelések mellett kísérleti eredmények is bizonyítják, hogy az alvó néven szólítása gyakrabban vezet ébredéshez, mint egy jelentés nélküli, de azonos erősségű hanggal való ingerlése. Az alvó agy tehát, jelentőségük alapján válogat az ingerek között. A jelentéssel bíró (személy nevének elhangzása) és jelentés nélküli hangingerek közötti különbséget funkcionális mágneses rezonanciával, a helyi agyi-oxigénfelhasználás révén vizsgálva, ébrenlétben és lassú hullámú alvásban meglepő egyezést találtak. Vagyis a jelentésre specifikus agyi aktiváció ébrenlétben és lassú hullámú alvásban egyaránt bevonta a középső halántéklebenyi agytekervényt és az orbitofrontális kérget (Portas és mtsai 2000). Ezzel szemben a személyes jelentést vagy sürgető jelzésérteket nélkülöző ingerek, lassú hullámú alvásban és ébrenlétben igen különböző hatásokkal jellemezhetőek. Alvásban nagy amplitúdójú reaktív lassú hullámokat (K-komplexusokat) és ezzel párhuzamosan kiterjedt agykérgi oxigén felhasználásban mutatkozó csökkenést váltanak ki. Ébrenlétben a jelentést nélkülöző hangingerek nyomán fokozódó oxigén felhasználást tapasztaltak a hallókéreg területén (Czisch és mtsai 2004). A jelentés nélküli ingerek alkalmazása nyomán tehát, egyfajta aktivitáscsökkenést figyeltek meg az alvó emberek agykérgében, míg ugyanezeknek az ingereknek a hatására ébrenlét állapotában az agykéreg helyi aktivitásfokozódást mozgósít. Korábban láttuk viszont, hogy a jelentésre specifikus agykérgi aktiváció, vélhetően az ébreszthetőség fenntartásának folyományaként, lassú hullámú alvásban sem tér el jelentősen az ébrenléthez viszonyítva. A fentiekhez hozzátehetjük még, hogy macskákban a talamusz kimeneteinek és bemeneteinek hányadosából képzett talamikus transzfer-arány állapotfüggőségét vizsgálva egyértelműen kiderült, hogy az az ébrenlét állapotában a legmagasabb (1 körüli), a lassú hullámú alvásban pedig, annak mélységétől függően 0,3 és 0,7 között változik. Mindazonáltal a lassú hullámú alvást jellemző alacsony talamikus információátvitel lehetővé tesz egy sekély, tudatalatti értékelést (Coenen 1995). Mindezeket a megfigyeléseket összegezve megkockáztatható az a következtetés, miszerint az alvás egyfajta fokozott válogatást jelent a jelentést hordozó és viszonylag kevés jelentéssel bíró ingerek között 7.10 Akkor mi a REM alvás, és mik az álmok?Az elméletileg fölmerülő három lehetőség a következő:
A homeoterm vívmánynak ellene szól, hogy épp maga a REM fázis, különös módon egy poikiloterm – azaz hőszabályozástól mentes – állapot (Parmeggiani és mtsai 1977). Hogy a fenti lehetőségek közül a legvalószínűbbre rámutathassunk, vissza kell utalnunk a hüllők primitív ébrenléti állapotára, ami az utóagy révén valósul meg, de inkább az emlősök lassú hullámú alvásához, és nem a REM fázishoz hasonlít. A második lehetőség ellen tehát már eddig is érveltünk. A REM alvás törzsfejlődésének vizsgálata két figyelemreméltó és némileg váratlan megfigyeléssel bővítette az alvás evolúciójára vonatkozó korai ismereteket. Az egyik a REM alvás összideje és a születéskori éretlenség (altricialitás) kapcsolata. Eszerint azoknak az emlősöknek van sok REM alvásuk, amelyek viszonylag éretlenül (csukott szemmel, a felnőtt agymérethez képest kicsi aggyal, csupaszon, helyváltoztatásra alkalmatlan anatómiával) születnek (Siegel 2001). Ilyenek például az oposszum (Lutreolina crassicaudata) vagy a menyét (Mustela nigripes). Előbbi átlagos napi 18 órai alvásából 6,6 órát tölt REM fázisban. Utóbbi 14,5 órából 6 órát. Ezzel szemben a viszonylagos érettséggel világra jövő tengeri malac vagy a juh (Ovis aries) napi 9,5 óra illetve 5,9 óra alvásából 1 illetve 0,6 óra REM alvás által elfoglalt periódusok Tudat és tudatzavar 10 összesített hossza. Ez a megfigyelés megerősíti az alvás egyedfejlődéséből kiinduló azon következtetést, miszerint a REM alvás egy diffúz endogén burst rendszer neoténikus maradványa (Blumberg és Lucas 1996). A REM alvás törzsfejlődésével kapcsolatos másik jelentős megfigyelés a ma létező emlősök legprimitívebbikénél, a tojást rakó kacsacsőrű emlősnél (Ornithorhynchus anatinus) megfigyelhető igen magas REM arányú alvás (14 órai összalvásból 8 óra REM). Ez a REM alvás azonban csak az agytörzsi aktivitás tekintetében egyezik meg a tipikus REM fázissal, az agykérget a NREM alvásra jellemző lassú hullámú aktivitás jellemzi. Lényegében azonos megfigyeléseket tettek a kloákások másik tagjánál, a tarajos sülnél (Tachyglossus aculeatus) is. Ezekből a megfigyelésekből adódik a következtetés, miszerint a REM alvás agytörzsi jellemzői (a szabálytalan agytörzsi unit aktivitás) egy igen ősi, kezdetleges formában minden bizonnyal már a hüllő ősöknél jelen lévő állapotból származnak. Vagyis a REM alvás evolúciós értelemben nem új, hanem régi állapot (Siegel és mtsai 1998) vagy régi alvásállapot (Nicolau és mtsai 2000; Gamundí és mtsai 2003). Újnak legfeljebb az ezzel járó kérgi aktiváció tekinthető. Vagyis a REM alvás valószínűleg egy ősi alvásállapot, az utóagy vagy az agytörzs alvása. A kérgi aktiváció, ami az álomélmények sokrétűségét maga után vonja, feltehetőleg nem magának a REM alvásnak, hanem az agyi serkentő- vagy ébresztőrendszereknek az evolúciója révén jött létre. Erre utaló adat a kacsacsőrű emlős és a tarajos sül agytörzsi és a bazális előagyi kolinerg rendszerei közötti hiátus, ami hipotalamuszból sajátosan hiányzó kolinerg neuroncsoportok miatt rajzolódik ki. Hasonló jellegzetesség lehet a kérgi kolinerg neuronok hiánya is az említett fajok egyedeiben (Manger és mtsai 2002a), ami megegyezik egy teknősfaj (Chrysemis picta picta) egyedeinek dorzális kotexében leírtakkal (Reiner 1991). Vagyis az agytörzs szintjén „zajló” REM alvás itt vélhetően fajspecifikus funkcionális neuroanatómiai sajátosságok miatt nem vezetődik tovább a kéregbe, de ettől a REM alvás még létezhet a szó hagyományos értelmében vett agykéreg nélküli fajokban (pl. hüllők) is. A kolinerg rendszer fejletlensége egyébként az emlősökre specifikus ébrenlét hiányával is összefüggésben állhat (ld. fentebb a farmakológiai megfontolásokat). Valószínűsíthető ezért, hogy a kolinerg rendszer törzsfejlődése inkább az ébrenlét szolgálatában állt, hatásait azonban a REM alvás mai megjelenési formájában is megtette. Az álmokat tehát az alvó utóagyra „ránőtt”, modern emlős-ébrenlétre képes előagy termékének tekinthetjük, aminek funkcionális sajátosságait a neurokémiai sajátosságok is meghatározzák (ld. az ember alvásállapotairól szóló leírást). A kolinerg rendszerrel szemben a katekolaminerg evolúciósan konzervatívnak mondható, mivel a katekolaminokat tartalmazó neuronok megoszlása és morfológiája kis különbségektől eltekintve megegyezik a legkülönbözőbb emlősfajok egyedeiben, beleértve a kacsacsőrű emlőst is. Ebből viszont az következik, hogy a kloákások alvásának más emlősökhöz viszonyítva sajátosnak mondható alvási jellegzetességei nem magyarázhatóak a katekolaminerg rendszer evolúciójával (Manger és mtsai 2002b). Ha mindezt tágabb kontextusba helyezzük, rámutathatunk, hogy a patkányok, macskák és közvetve az ember adrenerg rendszerében is kimutatott REM alvást jellemző szünetelő neurotranszmisszió az alvás egyik legősibb tulajdonsága, az agytörzs alvásának lényegi eleme. Ettől az előagy még részben lehet ébren is, hiszen megjelenése nem volt „belekalkulálva” a rendszer korai funkcionális állapotaiba. Ugyanakkor a REM alvás ciklikus megjelenése (ultradián szabályozása) filogenetikailag újnak tekinthető. Ennek megfelel a szabályozás anatómiai szubsztrátuma is: az ultradián alvásciklusok szabályozása az agytörzs hídi részében lokalizálható funkció (Hobson 1988), ugyanakkor a híd az agytörzs filogenetikai értelemben új struktúrája, amely az emlősökben – azokon belül is a fejlettebb előaggyal rendelkező emlősökben – figyelhető meg teljes biztonsággal (Zboray 2001). 7.11 Az alvás-ébrenléti állapotok egyedfejlődése: a törzsfejlődés megismétlése?Az alvás és ébrenléti állapotok evolúciójának fenti modelljére, minden eddigi modellel szemben érvényes a fejlődés azon elve miszerint az egyedfejlődés megismétli a törzsfejlődést. Nicolau és mtsai (2000) rámutatnak, hogy az ember egyedfejlődése során kezdetben az alvás dominál, ami ráadásul igen magas REM aránnyal jellemezhető. Az ébrenlét pusztán pár órát tesz ki a napból. Az egyedfejlődés iránya pedig az ébrenlét térhódításával és az alvás, különösen a REM háttérbe szorulásával jellemezhető. Mint ismert ez a folyamat később a lassú hullámú alvás idejének csökkenésével folytatódik. Vagyis a filogenetikailag legújabb állapot az ébrenlét jelenik meg a legkésőbb az egyedfejlődés során. Kezdetben az ősi alvásállapot (REM) és ősi ébrenléti állapot (lassú hullámú alvás) dominanciája figyelhető meg. A fenti megfigyelés azonban két további bizonyítékkal is kiegészíthető. Az egyik az újszülött patkányok viselkedéses aktivitással jellemezhető periódusainak az alvási orsózáshoz hasonló agyi elektromos aktivitásmintázatokkal való összefüggése (Khazipov és mtsai 2004). Vagyis az alvási orsók először ébrenlét közben jelennek meg, ami a hüllőkre jellemző elektrofiziológiai sajátosság (De Vera és mtsai 1994). Az alvás-ébrenlét állapotok egyedfejlődése még legalább egy tekintetben megismétli a törzsfejlődésüket. Extrém koraszülött csecsemők poligráfiás vizsgálata során kimutatták, hogy ebben az életkorban a szemmozgások jelenléte nagyobb amplitúdójú agyi elektromos tevékenységgel jár együtt, mint a szemmozgásokkal nem jellemezhető szakaszok (Vecchierini és mtsai 2003). Amennyiben a szemmmozgások ébrenléti állapotra utalnak, akkor az éber-aktív periódusok nagyobb amplitúdójú agyi elektromos tevékenységmintázata a hüllői lét elektrofiziológiai sajátosságának korábban kimutatott (Nicolau és mtsai 2000) vonásaihoz teszi hasonlatossá az összefüggést. Amennyiben REM alvást jelző szemmozgásokról van szó, úgy a nagy amplitúdójú EEG a primitív emlősök agytörzsre korlátozódó REM fázisához (Siegel és mtsai 1998) hasonlít. Mindkettő épp az ellenkezője annak, amit a felnőtt ember elektrofiziológiájával kapcsolatban általánosan érvényesnek tartunk. 7.12 A tudatállapotok evolúciója: összegzés és üzenet az alváskutatóknakAlvás és ébrenlét, lassú hullámú és REM alvás, mind a tudat jól elkülönülő megjelenési és szerveződési formái (Bódizs és Szendi 2005). Evolúciós eredetüket tekintve azonban mindannyian az aktivitás és a nyugalom egyetemes dualizmusából erednek. Mai formájuk az agy evolúciójával és a viselkedésvezérlés olyan újszerű elemeinek megjelenésével magyarázható, ami elsősorban az ébrenlét illetve a viselkedéses aktivitással jellemezhető periódusait alakította. Az evolúció feltehetően inkább az ébrenlétre, mint az alvásra gyakorolt nyomást, azt alakította (ki). Egyébként minden olyan elméletnek, amely az alvás valamely fázisának evolúciós „hasznát” akarja kimutatni, egyben arra is rá kell mutatnia, hogyan tud a környezet lassú hullámú és REM alvás között szelektálni? Hiszen ezt csak alváskutatók tudják elkülöníteni egymástól, a természetben pedig igen ritkák az alváskutatók (Gamundí és mtsai 2003) A tudat éber megjelenési formája olyan központi idegrendszeri struktúrákon alapul, amelyek evolúciós értelemben újnak mondhatóak. Vagyis ébren lenni egy modern dolog, amit neurokémiai terminusokban valószínűleg a kolinerg transzmisszió, illetve a kolinerg rendszer fejlettsége hoz létre. A fenti evolúciós okfejtéstől függetlenül is van okunk azt feltételezni, hogy az acetilkolin a tudat neurotranszmittere (Perry és mtsai 1999). Persze csak az éber tudaté. Elektrofiziológiailag a gyors agyi elektromos aktivitás jelenléte, illetve az ezzel való differenciált reagálási mód jellemzi ezt az új állapotot. Az ébrenlét állapotában potenciálisan minden inger jelentőséggel bírhat. Láttuk az értelmetlen hangingerek nyomán megjelenő következetes hallókérgi aktivációt. Ugyanez nem mondható el a lassú hullámú alvásról, amelynek során az alvó egyszerűen kiejti a jelentés nélküli ingereket a feldolgozandó, illetve komolyabb mérlegelést igénylő hatások sorából, akár egy állatkerti ketrecében jóllakottan pihenő krokodil az érdeklődő emberi tekinteteket. A REM fázis ellentmondásos jellegét a szakirodalom az alvó testben megjelenő látszólagos ébrenléti jelekben látja (Bódizs 2000). Hozzá kell tennünk, helyesen látja, de helytelenül értelmezi akkor, amikor ennek az alvás szempontjából történő funkcionális értelmezésével kísérletezik (Kavanau 1997; Jouvet 2001). Az ébrenlét fiziológiai jelei „valódiak”, amennyiben azok az ébrenlétre illetve a viselkedéses aktivitásra gyakorolt evolúciós nyomás termékei, és mint ilyenek a kolinerg rendszerrel illetve a fejlett előaggyal hozhatóak összefüggésbe. Ezek az ébrenlét neurofiziológiai mechanizmusai, amelyek akcidentálisan aktívvá válhatnak egy olyan ősi állapotban, amelyben az agytörzs filogenetikailag konzervatívnak mondható aminerg rendszere alszik. Hiszen ebbe az alvásba nem volt bekalkulálva a később oly fejlett formában megjelenő előagy, amelynek aktivitását ráadásul fölösleges is gátolni, hiszen a vázizmok biztonságos atóniája amúgy is megakadályozna minden jelentős kimenetet. A fenti nézetből következik, hogy az előagy által létrehozott és narratív struktúrákká szintetizált álmok fejlett előagyunk, és mint ilyenek az ébrenlétünk során szerzett tapasztalataink termékei. Ha egy alvó krokodilra egy emberi előagyat szerelhetnénk, az valószínűleg inkább álmodna beszélgetésről vagy lövöldözésről, mint szájtátogatásról és folyókon átgázoló antilopok megtizedeléséről. Ha az álmok megjelenítési módjának különlegességét illetve jelentésüket akarjuk kutatni, helyesen tesszük, és nem térünk le a tudomány útjáról. Persze ennek módszerei egyelőre legalább annyira rejtélyesek, mint az emberi lélek megragadásának fortélyai. Végül álláspontunk alátámasztása végett álljon itt egy rövid példaértékűnek szánt kitekintés az alvás szabályozásáról. Az alvásszabályozás kutatásában valóságos robbanás következett be az orexin nevű hipotalamikus neuropeptid ébrenlétet serkentő és/vagy stabilizáló szerepé nek kimutatásával (Mignot 2001; Saper és mtsai 2005). Valójában azonban az orexin, mint a neve is mutatja, a táplálékfelvétel serkentésére, tehát a túlélés szempontjából az egyik legfontosabb magatartásforma fokozására szakosodott peptidként vált ismertté, és csak ezt követően ismerték föl az emlősök alvásának szabályozásában játszott szerepét. Kevés figyelmet kapott az a tény, hogy pl. az aranyhal (Carassius auratus) agyában az orexinerg neuronok nélkülözik azokat a fontos szinaptikus kapcsolatokat, amelyek révén az emlősök ébrenlétét stabilizáló hatásukat kifejthetik. Ehelyett ebben a fajban, és vélhetően még sok másban is, az orexin egy létfontosságú életfunkció, az energiaháztartás szabályozására szakosodott, és csak az evolúció későbbi szakaszában válhatott az ébrenlét neuropeptidévé (Huesa és mtsai 2005). Biztosra vehető, hogy az aranyhalak is alszanak, de hogy a mi fogalmaink szerint fölébrednek-e az még nem nyert bizonyítást. Az orexinerg rendszerük mindenesetre nem segíti őket ebben. Köszönetnyilvánítás: A munka a Nemzeti Kutatási és Technológiai Hivatal (NKFP-1B/020/04) és az Országos Tudományos Kutatási Alapprogramok (OTKA TS-049785) támogatásával jött létre. A szerzőket a Magyar Tudományos Akadémia Bolyai János Kutatói ösztöndíjjal (BR), illetve az Oktatási Minisztérium Magyar Állami PhD ösztöndíjjal (CsSz) támogatták. Irodalomjegyzék1. Amzica F, Steriade M (1998). Electrophysiological correlates of sleep delta waves. Electroencephalogr Clin Neurophysiol 107:69-83. 2. Aserinsky E, Kleitman N (1953). Regularly occuring periods of eye motility and concomitent phenomena during sleep. Science 118:173-274. 3. Bassetti C, Vella S, Donati F, Wielepp P, Weder B (2000). SPECT during sleepwalking. Lancet 356:484-5. 4. Blumberg MS, Lucas DE (1996). A development and component analysis of active sleep. Dev Psychobiol 29:1-22. 5. Bódizs R (2000). Alvás, álom, bioritmusok. Budapest: Medicina. 6. Bódizs R, Szendi G (2005). Éberség, tudat, normális és megváltozott tudatállapotok. In: Kopp M, Berghammer R (szerk). Orvosi pszichológia. Budapest: Medicina, 43-67. 7. Bódizs R, Kis T, Lázár AS, Havrán L, Rigó P, Clemens Z, Halász P (2005a). Prediction of general mental ability based on neural oscillation measures of sleep. J Sleep Res 14:285-92. 8. Bódizs R, Kis T, Lázár AS, Havrán L, Clemens Z, Halász P (2005b). Visuospatial abilities and sleep-dependent EEG oscillations: frequency- and region-specific correlations. Sleep Med 6:S86-7. 9. Broughton R (1968). Sleep disorders: disorders of arousal? Enuresis, somnambulism, and nightmares occur in confusional states of arousal, not in ‘dreaming sleep’. Science 159:1070-8. 10. Bullock TH, Başar E (1988). Comparison of ongoing compound field potentials in the brain of invertebrates and vertebrates. Brain Res Rev 13:57-75. 11. Buzsáki G (1986). Hippocampal sharp waves: their origin and significance. Brain Res 398:242-52. 12. Carlson NR (1991). Physiology of behavior. Boston: Allyn and Bacon. 13. Changizi MA (2003). Relationship between number of muscles, behavioral repertoire size, and encephalization in mammals. J Theor Biol 220:157-68. 14. Coenen AML (1995). Neuronal activities underlying the electroencephalogram and evoked potentials of sleeping and waking: implications for information processing. Neurosci Biobehav Rev 19:447-63. 15. Contreras D, Destexhe A, Sejnowski TJ, Steriade M (1997). Spatiotemporal patterns of spindle oscillations in cortex and thalamus. J Neurosci 17:1179-96. 16. Czisch M, Wehrle R, Kaufmann C, Wetter TC, Holsboer F, Pollmächer T, Auer DP (2004). Functional MRI during sleep: BOLD signal decreases and their electrophysiological correlates. Eur J Neurosci 20(2):566-74. 17. Datta S, Siwek DF, Patterson EH, Cipolloni PB (1998). Localization of pontine PGO wave generation sites and their anatomical projection sin the rat. Synapse 30:409-23. 18. Dawson GD (1954). A summation technique for the detection of small evoked potentials. Electroencephalogr Clin Neurophysiol 6:65-84. 19. De Gennaro L, Ferrara M, Bertini M (2000). Topographical distribution of spindles: variations between and within NREM sleep cycles. Sleep Res Online 3:155-60. 20. De Vera L, González J, Rial RV (1994). Reptilian waking EEG: slow waves, spindles and evoked potentials. Electroencephalogr Clin Neurophysiol 90:298-303. 21. De Vera L. González J, Pereda E (2000). Relationship between cortical electrical and cardiac autonomic activities in the awake lizard, Gallotia galloti. J Exp Zool 287:21-8. 22. De Vera L, Pereda E, Santana A, González JJ (2005). Time-related interdependence between low-frequency cortical electrical activity and respiratory activity in lizard, Gallotia galloti. J Exp Zool 303A:217-26. 23. Dringenberg HC, Vanderwolf CH (1998). Involvement of direct and indirect pathways in electrocorticographic activation. Neurosci Biobehav Rev 22:243-57. 24. Driver HS, Dijk DJ, Werth E, Biederman K, Borbély AA (1996). Sleep and the sleep electroencephalogram across the menstrual cycle in young healthy women. J Clin Endocrinol Metab 81:728-35. 25. Fjell AM, Walhovd KB, Reinvang I, Lundervold A, Dale AM, Quinn BT, Makris N, Fischl B (2005). Age does not increase rate of forgetting over weeks–Neuroanatomical volumes and visual memory across the adult life-span. J Int Neuropsychol Soc 1:2–15. 26. Gamundí A, González J, Akâarir M, Nicolau MC, Esteban S, Coenen AML, Rial Planas RV (2003). Dualism and uniformism in sleep. Med Hypotheses 60:116-8. 27. Gamundí A, Akaârir M, Coenen AML, Esteban S, Rial RV, Nicolau MC (2005). Mammalian sleep may have no adaptive advantage over simple activity-rest cycles. Med Hypotheses 64:130-2. 28. Gang-Vu TT, Desseilles M, Laureys S, Degueldre C, Perrin F, Phillips C, Maquet P, Peigneux P (2005). Cerebral correlates of delta waves during non-REM sleep revisited. Neuroimage 28:14-21. 29. Gao BO, Franken P, Tobler I, Borbély AA (1995). Effect of elevated ambient temperature on sleep, EEG spectra, and brain temperature in the rat. Am J Physiol 268:R1365-73. 30. Garau C, Aparicio S, Rial RV, Esteban S (2005a). La evolución del sueño: las aves en la encrucijada entre mamíferos y reptiles. Rev Neurol 40:423-30. 31. Garau C, Aparicio S, Esteban S, Nicolau MC, Rial RV (2005b). The sleep in birds: two states or only one? Sleep Biol Rhythms 3(Suppl 1):A58. 32. García-García F, Drucker-Colín R (1999). Endogenous and exogenous factors on sleep- wake cycle regulation. Prog Neurobiol 58:297-314. 33. Gaztelu JM, García-Austt E, Bullock TH (1991). Electrocorticograms of hippocampal and dorsal cortex of two reptiles: comparison with possible mammalian homologs. Brain Behav Evol 37:144-60. 34. González J, Gamundí A, Rial R, Nicolau MC, de Vera L, Pereda E (1999). Nonlinear, fractal, and spectral analysis of the EEG of lizard, Gallotia galloti. Am J Physiol Regul Integr Comp Physiol 277:86-93. 35. Gray JR, Thompson PM (2004). Neurobiology of intelligence: science and ethics. Nat Rev Neurosci 5:471-82. 36. Gusnard DA, Raichle ME (2001). Searching for a baseline: functional imaging and the resting human brain. Nat Rev Neurosci 2:685-94. 37. Halász P (1993). Arousals without awakening–Dynamic Aspect of sleep. Physiol Behav 54:795-802. 38. Halász P, Terzano M, Parrino L, Bódizs R (2004). The nature of arousal in sleep. J Sleep Res 13:1-23. 39. Hilakivi I, Makela J, Leppavuori A, Putkonen PT (1978). Effects of two adrenergic beta- receptor blockers on the sleep cycle of the cat. Med Biol 56:138-43. 40. Hobson JA (1988). The dreaming brain. New York: Basic Books. 4. Hobson JA, Pace-Schott EF (2002). The cognitive neuroscience of sleep: neuronal systems, conscious ness and learning. Nat Rev Neurosci 3:679-93. 42. Horne JA (1993). Human sleep, sleep loss and behaviour: implications for the prefrontal cortex and psychiatric disorders. Brit J Psychiatry 162:413-9. 43. Huesa G, van den Pol AN, Finger TE (2005). Differential distribution of hypocretin (orexin) and melanin-concentrating hormone (MCH) in the goldfish brain. J Comp Neurol 488:476-91. 44. Hughes SW, Crunelli V (2005). Thalamic mechanisms of EEG alpha rhythms and their pathological implications. Neuroscientist 11:1-16. 45. Ishii R, Dziewas R, Chau W, Sörös P, Okamoto H, Gunji A, Pantev C (2003). Current source density distribution of sleep spindles in humans as found by synthetic aperture magnetometry. Neurosci Lett 340:25-8. 46. Jouvet M (2001). Alvás és álom. Budapest: Typotex. 47. Kavanau JL (1997). Origin and evolution of sleep: roles of vision and endothermy. Brain Res Bull 42:245-64. 48. Khazipov R, Sirota A, Leinekugel X, Holmes GL, Ben-Ari Y, Buzsáki G (2004). Early motor activity drives spindle bursts in the developing somatosensory cortex. Nature 432:758-61. 49. Kleinlogel H. (1983). Sleep in various species of laboratory animlas. Neuropsychobiology 9:174-7. 50. Lancel M (1993). Cortical and subcortical EEG in relation to sleep-wake behavior in mammalian species. Neuropsychobiology 28:154-9. 51. Lancel M, van Riezen H, Glatt A (1992). Enhanced slow-wave activity within NREM sleep in the cortical and subcortical EEG of the cat after sleep deprivation. Sleep 15:102-18. 52. Mahowald MW, Schenck CH (2005). Insights from studying human sleep disorders. Nature 437:1279-85. 53. Malow BA, Carney PR, Kushwaha R, Bowes RJ. (1999) Hippocampal sleep spindles revisited: physiologic or epileptic activity? Clin Neurophysiol 110:687-93. 54. Manger PR, Fahringer HM, Pettigrew JD, Siegel JM (2002a). The distribution and morphological characteristics of cholinergic cells in the brain of monotremes as revealed by ChAT immunohistochemistry. Brain Behav Evol 60:275-97. 55. Manger PR, Fahringer HM, Pettigrew JD, Siegel JM (2002b). The distribution and morphological characteristics of catecholaminergic cells in the brain of monotremes as revealed by tyrosine hydroxylase immunohistochemistry. Brain Behav Evol 60:298-314. 56. Mignot E (2001). A commentary ont he neurobiology of the hypocretin/orexin system. Neuropsychopharmacology 25:S5-S13. 57. Nicolau MC, Akaârir M, Gamundí A, González J, Rial RV (2000). Why we sleep: the evolutionary pathway to the mammalian sleep. Prog Neurobiol 62:379-406. 58. Pace-Schott EF, Hobson JA (2002). The neurobiology of sleep: genetics, cellular physiology and subcortical networks. Nat Rev Neurosci 3:591-605. 59. Parmeggiani PL, Zamboni G, Cianci T, Calasso M (1977). Absence of thermoregulatory vasomotor responses during fast wave sleep in cats. Electroencephalogr Clin Neurophysiol 42:372-81. 60. Perry E, Walker M, Grace J, Perry R (1999). Acetylcholine in mind: a neurotransmitter correlate of consciousness? Trends Neurosci 22:273-80. 61. Portas CM, Krakow K, Allen P, Josephs O, Armony JL, Frith CD (2000). Auditory processing across the sleep-wake cycle: simultaneous EEG and fMRI monitoring in humans. Neuron 29:991-9. 62. Rattenborg NC (2006). Evolution of slow wave sleep and palliopallial connectivity in mammals and birds: a hypothesis. Brain Res Bull 69:20-9. 63. Rechtschaffen A, Kales A (1968). A Manual of Standardized Terminology, Techniques and Scoring System for Sleep Stages of Human Subjects. Los Angeles: UCLA, Brain Information Service. 64. Reiner A (1991). A comparison of neurotransmitter-specific and neuropeptide-specific neuronal cell types present in the dorsal cortex in turtles with those present in the isocortex in mammals: implications for the evolution of isocortex. Brain Behav Evol 38:53-91. 65. Saper CB, Cano G, Scammel TE (2005). Homeostatic, circadian and emotional regulation of sleep. J Comp Neurol 493:92-8. 66. Siegel JM (2001). The REM sleep-memory consolidation hypothesis. Science 294:1058-63. 67. Siegel JM, Manger PR, Nienhuis R, Fahringer HM, Pettigrew JD (1998). Monotremes and the evolution of rapid eye movement sleep. Phil Trans R Soc Lond B 353:1147-57. 68. Sjölander S (1995). Some cognitive breakthroughs in the evolution of cognition and conciousness and their impact on the biology of language. Evol Cogn 1:3-11 69. Vecchierini MF, d’Allest AM, Verpillat P (2003). EEG patterns in 10 extreme premature neonates with normal neurological outcome: qualitative and quantitative data. Brain Dev 25:330-7. 70. Velluti JC, Russo RE, Simini F, García-Austt E (1991). Electroencephalogram in vitro and cortical transmembrane potentials in the turtle Chrysemys d’orbigny. Brain Behav Evol 38:7-19. 71. Zboray G (2001). Összehasonlító Neuroanatómiai Praktikum I-II. Budapest: Nemzeti Tankönyvkiadó
|